
Коралловый бычок G. histrio, приплывший на призыв коралла, чтобы избавить его от токсичной зелёной водоросли C. fastigiata (фото Danielle Dixson / Georgia Institute of Technology).
К.С.Ткаченко
Аннотация. К настоящему времени более четверти тропических коралловых рифов Мировою океана считаются полностью разрушенными, а в ближайшие 30 лет при сохранении нынешней скорости деградации эта величина может удвоиться. Разрушение коралловых экосистем для значительной части прибрежного населения планеты означает потерю основного источника пищевых ресурсов, естественной защиты от ураганов и штормов, существенных, если ни единственных, доходов от использования рифов, в том числе и в туристической индустрии. Наконец, это угроза лишения и жизненною пространства (в случае разрушения заселенных низменных коралловых островов).
Глобальные негативные воздействия включают в себя температурные аномалии поверхностных вод и повышение содержания С02 в атмосфере, вызывающее окисление Мировою океана.
К локальным негативным воздействиям относятся повышение седиментации и эвтрофикации, прохождение циклонов и штормов, болезни кораллов, химические загрязнения, механическое разрушение кораллов человеком, антропогенное истощение функциональных групп рыб и беспозвоночных.
В настоящем обзоре обсуждается весь спектр реакций коралловых сообществ на эти стрессовые воздействия как на уровне отдельных таксонов, так и экосистемы в целом. Анализ литературных данных позволяет предполагать с высокой вероятностью, что к середине текущего столетия тропические коралловые сообщества будут находиться в фазе коллапса более чем на 50% площади своею биогеографического распространения, особенно в районах с высокой плотностью человеческого населения. В результате комплексного воздействия рассмотренных в обзоре негативных факторов в наиболее оптимистичном варианте коралловые экосистемы в отдельных акваториях сохранятся.
Однако после глобальных трансформаций в них будут преобладать наиболее устойчивые таксоны, преимущественно корковые и массивные формы многолетних, медленно растущих видов с высокой конкурентоспособностью. Наиболее высокие показатели по этим признакам у поритид. В наиболее пессимистичном варианте сообщества склерактиний повсеместно будут замещены альтернативными сообществами макроводорослей или кораллов, не имеющих известковою скелета.
***
Коралловые рифы являются одними из самых богатых по биоразнообразию и высоких по продуктивности экосистем на нашей планете. В то же время это одна из самых древних экосистем, берущих начало с середины Мезозойской эры, но в современном виде сформировавшаяся в позднем Плейстоцене около 10 тыс. лет назад (Veron, 2000). Как геологические структуры коралловые рифы представляют собой подводные и надводные известковые поднятия (гряды), сформированные преимущественно скелетами колониальных кораллов в мелководных участках тропических морей. Область распространения современных рифообразующих кораллов охватывает широкий пояс в тропической зоне Мировою океана по обе стороны от экватора между северным Тропиком Рака и южным Тропиком Козерога, хотя в некоторых районах теплые течения способствуют их развитию и в более высоких широтах вплоть до 31° в обоих полушариях. Только рифообразующих кораллов насчитывается более 1500 видов (Veron, 2000), которые в свою очередь формируют среду обитания по разным данным для 35-60 тыс. видов морских организмов, и эти цифры далеко нс окончательные. Наибольшее разнообразие кораллов приурочено к Индо-Пацифичскому региону, особенно району Юго-Восточной Азии (“Коралловому Треугольнику”), в тропической Атлантике (в основном Карибском регионе) насчитывается всего чуть более 70 видов рифообразующих кораллов (Veron, 2000).
Для человечества коралловые рифы имеют важнейшее, а в отдельных случаях и основополагающее значение, являясь в буквальном смысле землей обитания (коралловые острова) и основным источником пищевых ресурсов для местного населения. Коралловые рифы защищают берега от волнового воздействия и для многих приморских тропических стран являются важным источником дохода от использования богатых биоресурсов рифов и от интенсивно развивающегося туризма.
С ростом населения планеты и глобальным изменением климата, которое связывают с индустриальной революцией, коралловые рифы претерпели значительные, а в некоторых регионах катастрофические изменения, выраженные в частичной или полной деградации самих кораллов и истощении всех функциональных групп, обеспечивающих устойчивое состояние экосистемы. К настоящему времени около 20% всех коралловых рифов Мирового океана считаются полностью разрушенными (покрытие кораллами менее 5%). а в ближайшие 10-20 лет доля деградированных рифов увеличится еще как минимум на 15% (Wilkinson, 2008). Покрытие склерактиниями в коралловых сообществах Индо-Пацифики снизилось в среднем с 42.5% в начале 1980-х до 22.1% к 2003 г. (Вruno, Selig, 2007), и очевидно, что спустя десятилетие, к 2015 г., эта величина стала еще меньше. На карибских коралловых рифах покрытие живых кораллов с 1970-х годов снизилось па 80% и сейчас составляет в среднем только 13% (Wilkinson, Souter, 2008). Продукция карбоната кальция снизилась на 50% но сравнению со средними показателями для голоценовых рифов Карибского бассейна (с 3.1-3.8 до 1.2-2.3 мм/ год). Более трети от всех исследованных рифов региона стали полностью эрозионными, т.с. прироста карбонатного каркаса на них не происходит.
Таким образом, к настоящему времени около 75% всех коралловых рифов Мирового океана находятся под угрозой частичной или полной деградации (Burke et al., 2011).
Несмотря на большое число публикаций по данной проблеме, в отечественной научной литературе рассматриваются лишь отдельные негативные воздействия и связанные с ними изменения в коралловых экосистемах (Наумов и др., 1985; Преображенский, 1986; Павлов и др., 2004; Латыпов. 2006; Титлянов. Тиглянова, 2008; Ткаченко, 2014). Цель настоящего обзора - рассмотреть основные абиотические и биотические факторы, вызывающие негативные изменения в коралловых сообществах на всех уровнях и определить возможные сценарии дальнейшего развития экосистем тропических коралловых рифов в текущем столетии.
Температурные аномалии
Содержание
- 1 Температурные аномалии
- 2 Повышение содержания СО2 в атмосфере и кислотности Мирового Океана
- 3 Болезни кораллов
- 4 Тропические циклоны и штормы
- 5 Седиментация и эвтрофикация
- 6 Типы фазовых сдвигов и роль функциональных групп в коралловых сообществах
- 7 Химическое загрязнение
- 8 Механическое разрушение кораллов человеком
- 9 Заключение
За последние 30 лег по всему поясу распространения коралловых рифов в Мировом океане происходит широкомасштабная гибель рифообразующих кораллов, вызванная повышением температуры морской воды. Температурные аномалии обусловлены, с одной стороны, глобальным потеплением климата, результатом которого стало увеличение температуры Мирового океана за последние 100 лет на I °С. C другой стороны, с середины XX в. отмечается увеличение частоты и продолжительности Южной осцилляции (Эль-Ниньо) в Тихом океане, вызывающей периодические превышения среднемноголстних температурных максимумов, к которым адаптированы кораллы. Влияние Эль-Ниньо считается более связанным с массовой эпизодической смертностью кораллов в Индо-Пацифике.
Коралловые симбионты Symbiodinium
При повышении температуры выше среднемноголетних максимумов происходит обесцвечивание кораллов в результате выброса коралловыми полипами эндосимбиотических водорослей динофлагеллят (зооксантелл) из рода Symbiodinium, как реакции на шоковые температуры (Glynn, 1993; Brown, 1997). Изучение скорости формирования рифов и роста кораллов за последнее тысячелетие позволило полагать, что массовым и широкомасштабным явлением обесцвечивание стало с конца 70-х годов XX в., что связывают с глобальными изменениями климата (Glynn, 1991; Goreau, 1992). Первое широкомасштабное обесцвечивание с последующим локальным вымиранием кораллов произошло в восточной части Тихого океана в 1982-1983 гг. во время особо сильного явления Эль-Ниньо (Glynn, 1990). В конце XX в., в 1997 1998 гг., на большей части Индо-Пацифики и в некоторых районах Карибского региона сильные и продолжительные температурные аномалии с превышением среднемноголетних максимумов на 1-3 °С, а в некоторых районах на 5-7 °С, вызвали беспрецедентное по масштабам обесцвечивание и гибель кораллов в поясе распространения тропических коралловых рифов (Wilkinson, 1998). В течение последующего десятилетия гибель кораллов в меньших масштабах, но также по всему тропическому поясу Мирового океана в результате повышения температуры воды была отмечена в 2002, 2005 и 2010-2011 гг. (www.reefbase.org).
Причем для Карибского бассейна 2005 г. был наиболее драматичным. Тогда от температурных аномалий и ураганов погибло около 50% коралловых сообществ (Wilkinson, Souter, 2008). Недавняя температурная аномалия 2010-2011 гг. для некоторых районов Индийского океана была сравнима или даже превосходила эпизод 1998 г., когда было уничтожено от 70 до 90% кораллового покрытия на рифах Лаккадивских и северных Мальдивских островов, Таиланда (Кrishnan et al., 2011), Индонезии (Guest et al., 2012) и западной Австралии (Мооге et al., 2012). По ряду прогнозов, частота и сила обесцвечивания и последующего вымирания кораллов в текущем столетии будет возрастать и достигнет ежегодной периодичности в Юго-Восточной Азии и Карибском бассейне к 2020 г., на Большом Барьерном рифе — к 2030 г., а в центральной части Тихого океана - к 2040 г.
Повышение температуры ускоряет метаболизм кораллов и фотосинтез зооксантслл и приводит к образованию токсичных концентраций вырабатываемого кислорода, что активирует массовый сброс полипами зооксантелл, вызывающий потерю окраски (Veron, 2008). Плотность популяций зооксантелл в тканях коралловых полипов в норме очень высокая (более 106/см2) и обеспечивает до 90% пищевых потребностей кораллов (Muscatine, Porter, 1977). Соответственно, если температурная аномалия имеет большую длительность и (или) амплитуду, кораллы деградируют и гибнут в результате отравления кислородными радикалами и продолжительного голодания. Так как тропические рифообразующие кораллы являются стенотермными организмами, обитающими у верхней границы своей температурной устойчивости, повышение температуры воды только на 1 °С выше средне- многолетнего максимума вызывает их массовое обесцвечивание (Goreau, Hayes, 1994).
Установлено, что обесцвечивание кораллов начинается в периоды слабого ветрового воздействия и высокой прозрачности воды, когда условия способствуют прогреванию волы и глубокому проникновению солнечной радиации в водную толщу (Glynn, 1993). Эксперименты как в лабораторных, так и в полевых условиях показывают, что обесцвечивание кораллов на мелководье, особенно на литорали, вызывается комбинированным воздействием повышенной освещенности и температуры (Преображенский. 1986, Вгоwn, 1997). При перегреве или переохлаждении негативный эффект повышения освещенности выше, чем при нормальной температуре. При этом ингибируется фотосинтетический аппарат зооксантелл, происходит их потеря кораллами, что приводит к сокращению усвоения углерода, замедлению скорости роста и увеличению смертности кораллов (Преображенский, 1986). Влияет ли повышение интенсивности солнечного излучения в диапазоне физиологически активной радиации (ФАР, 400-700 nm) или только в УФ спектре (280-400 nm) на инициацию обесцвечивания кораллов, остается вопросом спорным (Вгоwn, 1997).
Исследования, проведенные в различных районах Индо-Пацифики, позволили установить специфичные реакции обесцвечивания на температурный стресс и последующий уровень смертности для большинства родов рифообразующих кораллов. На основе этих данных кораллы можно разделить по их устойчивости к повышению температуры воды выше среднемноголетних максимумов на три условных категории: “чувствительные”, “толерантные” и “резистентные” (таблица). Установлено, что одни и те же таксоны как в соседних, так и в географически удаленных друг от друга регионах имеют сходную реакцию обесцвечивания (МсСlanahan, 2004).
 Однако у одного и того же вида в пределах одного рифа с течением времени может происходить адаптация к повышению температуры с полной реверсией термочувствительности (Guest et al., 2012). Серии температурных аномалий привели к локальному исчезновению чувствительных таксонов в первую очередь Acropora из южной части Персидского залива (Вurt et al., 2013) и ряда районов Андаманского залива (Кrishnan et al., 2011). Глобальная температурная аномалия 1998 г., по-видимому, способствовала локальному вымиранию в акватории Мальдивских островов трех термочувствительных родов — Stylophora, Seriatopora и гидрокоралла Millepora (Ткаченко, 2012, 2014).
Однако у одного и того же вида в пределах одного рифа с течением времени может происходить адаптация к повышению температуры с полной реверсией термочувствительности (Guest et al., 2012). Серии температурных аномалий привели к локальному исчезновению чувствительных таксонов в первую очередь Acropora из южной части Персидского залива (Вurt et al., 2013) и ряда районов Андаманского залива (Кrishnan et al., 2011). Глобальная температурная аномалия 1998 г., по-видимому, способствовала локальному вымиранию в акватории Мальдивских островов трех термочувствительных родов — Stylophora, Seriatopora и гидрокоралла Millepora (Ткаченко, 2012, 2014).
Адаптивная реакция на воздействие повышенной температуры в коралловых сообществах происходит как на уровне вида (формирование резистентности на основе генотипической адаптации и фенотипической акклиматизации), так и на уровне сообщества (формирование устойчивых к температурным аномалиям сообществ как результат сдвига в видовом составе в сторону резистентных видов). Растущий массив работ свидетельствует о ведущей роли генотипа зооксантелл в устойчивости герматипных кораллов к температурным шоковым воздействиям. Эти исследования показали, что кораллы, содержащие симбиотические водоросли с генотипом D. более устойчивы к температурным стрессам, чем кораллы, содержащие эндосимбионтов с доминирующим генотипом С. Более того, в коралловых сообществах, подверженных периодическому воздействию температурных стрессов, кораллы с эндосимбионтами генотипа D начинают доминировать (Ваkеr et al., 2004). Однако остается вопрос, является ли преобладание в таких сообществах кораллов, содержащих D-симбионтов, результатом дифференцированного выживания хозяев D-симбионтов, или замещением генотипа С на генотип D в выживших кораллах как адаптивной реакции па стресс (Ваker et al., 2004; Веrkelmans, Орреn, 2006). Многие виды кораллов содержат сразу несколько генотипов зооксантелл в тканях и, по-видимому, могут изменять концентрации эндосимбионтов разных генотипов в ответ на температурное воздействие <>.
Следует также отметить, что генотип D у зооксантелл далеко не всегда является более термоустойчивым, чем генотип С. Например, кораллы из рода Роrites, которые считаются наиболее устойчивыми к температурным аномалиям, до настоящего времени ассоциируются только с эндосимбионтами генотипа С (LaJcunesse et al., 2003; Stat et al., 2009). Кроме того, показано, что кораллы с доминированием эндосимбионтов генотипа D значительно снижают скорость роста (на 40-75%) по сравнению с кораллами, в чьих тканях преобладают менее устойчивые к температурным аномалиям зооксантеллы. Таким образом, увеличение доли кораллов с D-симбионтами в коралловом сообществе, с одной стороны, повышает устойчивость сообщества к температурным стрессам, но, с другой стороны, может снижать способность сообщества к восстановлению при хронических и разнородных стрессовых воздействиях в результате общего замедления роста и формирования карбонатного каркаса рифа.
Сами хозяева эндосимбионтов — коралловые полипы - имеют видоспецифичную вариабельность в устойчивости к температурному стрессу. Она обусловлена способностью вида к гетеротрофному питанию в период обесцвечивания (Grottoli et al., 2006); морфологическими особенностями, выраженными в форме роста (массивные или ветвистые) и толщине мягких тканей (Wooldridge, 2013); физиологическими адаптивными реакциями, такими как продукция флуоресцентных протеинов, микоспорин-подобных аминокислот и антиокислительных энзимов, смягчающих воздействие шоковых температур и УФ-радиации и способствующих выживанию кораллов (Вrown, 1997; Ваird et al., 2009). Другим физиологическим механизмом является способность некоторых кораллов массивных форм (Gоniastrea, Leptoria, Соеloseris, Galaxea) глубоко втягивать ткани полипов внутрь кораллитов во время температурного стресса, что приводит к значительному уменьшению интенсивности окраски (побледнение цвета) без какого-либо снижения концентрации зооксантелл и хлорофилла (Вrown et al., 1994). Совокупность всех названных адаптивных стратегий позволяет части рифообразующих кораллов успешно приспосабливаться к изменению температурного режима.
На уровне кораллового сообщества реакция на температурные стрессы происходит по четырем основным сценариям (Done, 1999);
-
акклиматизация кораллов с помощью описанных выше генотипических и фенотипических адаптаций, в результате которой сообщество в целом не показывает каких-либо значимых изменений в видовом составе и обилии видов;
-
быстрая реорганизация сообщества, которая предполагает увеличение смертности и снижение продолжительности жизни: в сообществе остаются те же виды, по возрастая структура сдвигается в сторону преобладания молоди;
-
стратегический сдвиг-предполагает замещение чувствительных таксонов (Acroporidae и Роcilloporidae и т.д.) более термоустойчивыми таксонами (Роritidae, Faviidae, Аgariciidae и т.д.). Этот процесс уже начался в некоторых районах, где происходит выборочная элиминация кораллов и некоторые виды становятся редкими (Ноeg-Guldberg, 1999);
-
фазовый сдвиг - предполагает замещение рифообразующих кораллов другими группами сессильных бентосных организмов (макроводоросли, кораллиморфарии. губки). Этот сценарий также становится широко распространенным и описывается как для Индо-Пацифики, так и для Карибского региона (Chadwick, Моrrow, 2011).
По мнению Вирона (Veron, 2011), при увеличении частоты массовою обесцвечивания кораллов, которое прогнозируется на текущие десятилетия, коралловые сообщества верхней сублиторали будут представлены в основном небольшими колониями наиболее быстро восстанавливающихся видов. Видовая реорганизация сообщества будет иметь место, но без особых изменений в общем обилии кораллов. Таким образом, согласно Вирону вторая и третья фазы могут быть совмещены.
Особенности окружающей среды, такие как близость кораллового рифа к апвеллинговым выносам глубокой и более холодной воды, быстрое течение, сложная структура рифа, крутой рифовый склон или высокий профиль береговой линии, могут смягчать воздействие повышенной температуры и УФ-радиации в результате охлаждения поверхностного слоя, интенсификации вымывания токсичных кислородных радикалов из колоний кораллов и затенения мелководных коралловых поселений (West, Salm, 2003; Lenihan, 2008). Немаловажную роль могут играть исторически сложившиеся и географически полуизолированные убежища (рефугиумы), где совокупность условий среды способствует акклиматизации кораллов к меняющейся среде.
Например, большой и глубокий залив Акаба, являющийся северо-восточным “рукавом” Красного моря, предположительно является таким рефугиумом с кораллами, имеющими чрезвычайно высокий температурный порог обесцвечивания (Fine et al., 2013). Этому способствовали тысячелетия естественного отбора коралловых планул с наиболее устойчивым к температурному стрессу генотипом благодаря природному тепловодному барьеру Баб-эль-Мандебского пролива и южной части Красного моря, которые планулы должны преодолевать при движении с течением из Аденского залива Индийского океана в Красное море.
Повышение содержания СО2 в атмосфере и кислотности Мирового Океана
Рост концентрации углекислого газа в атмосфере от сжигания углеродного топлива и вырубки лесов имеет как прямое, так и опосредованное влияние на морские экосистемы. Опосредованное влияние выражается в устойчивом увеличении температуры поверхностных вод океана (сейчас она на 0.7 градуса выше значений, бывших в начале индустриальной эпохи), причиной которого является “парниковый эффект” в результате повышения концентрации С02 в атмосфере. Глобальные изменения атмосферы, вызванные изменением концентрации углекислого газа, увеличивают частоту и интенсивность штормов и дождей, которые, в свою очередь, влияют на соленость и концентрацию терригенных осадков и биогенов в воде (IРСС, 2007).
Увеличение концентрации углекислого газа имеет и прямое воздействие на морские экосистемы. По данным Национального управления по океану и атмосфере США (NOAA) концентрация углекислого газа в атмосфере [С02(аtm)] на декабрь 2013 г. достигла 396.8 ррm (769 мг/м3), что на 50-100% превышает исторический диапазон 200-300 ррm, существовавший последние 2 млн. лет (Нönish et al., 2009). Результатом таких изменений стало увеличение парциального давления двуокиси углерода в морской воде (рС02), что уже вызвало уменьшение рН воды на 0.1 и привело к снижению концентрации карбонат-ионов на 30 ммоль/кг и снижению насыщения воды частицами карбоната кальция на 15%, хотя последняя величина имеет пространственную вариабельность.
При растворении углекислого газа в воде увеличиваются концентрации угольной кислоты (Н2С03), а также гидрокарбонат-анионов (НСО3-) и свободного водорода (Н+), но снижается содержание карбонатов (СО32+), следовательно, уменьшается рН. Карбонат-ионы являются основным элементом в процессе биологической кальцификации морских организмов. Предел, до которого гидробионты с известковым скелетом могут выдерживать воздействие океанского окисления, зависит от степени насыщения карбоната кальция (WСаСО3). Различные пороговые значения этого показателя соответствуют трем формам карбоната кальция, секретируемого морскими организмами: арагониту (вырабатывается кораллами, макроводорослями и некоторыми моллюсками), доломиту (характерен для кораллиновых водорослей) и кальциту (вырабатывается большинством моллюсков, фораминиферами и палеозойскими кораллами) (Veron, 2011). Наиболее высокие показатели ΩСаСО3, приурочены к тропикам, а наиболее низкие — к высоким широтам, главным образом в результате того, что СО2, более растворим в холодных водах, снижая в них концентрацию карбонат-ионов (Кеннет, 1987).
Модельные расчеты, краткосрочные мезокосмовые эксперименты с различными уровнями рСО2, и рН. а также наблюдения, проведенные на естественных вулканогенных выходах углекислого газа на морском дне, показали, что увеличение кислотности океана и снижение ΩСаСО3, ведут к негативным и даже катастрофическим последствиям для коралловых сообществ, результатом которых может быть широкомасштабное обесцвечивание и гибель кораллов, глобальное снижение биоразнообразия и деградация большей части современных коралловых рифов. В частности, уменьшение рН приводит к следующим негативным последствиям:
1) увеличивается растворимость известковых скелетов и уменьшается скорость кальцификации кораллов и кораллиновых водорослей;
2) снижается видовое разнообразие кораллов, продукция гамет, обилие и выживаемость молодых колоний;
3) снижается интенсивность размножения, рост и обилие известковых кораллиновых водорослей.
Кораллиновые водоросли играют важнейшую роль в функционировании коралловых рифов, являясь основным цементирующим элементом, скрепляющим рифовый каркас. Кроме того, планулы кораллов избирательно оседают на корковых известковых водорослях, где находят благоприятные условия для развития. У большей части кораллиновых водорослей скелет состоит из доломита, который имеет большую растворимость, чем арагонит и кальцит в составе других известковых организмов, и требует более высоких для отложения в тканях водорослей (и соответственно больше затрат энергии на метаболизм) (Feely et al., 2004);
4) снижается прочность известковых скелетов кораллов в результате декальцификации и увеличивается подверженность механическому разрушению при воздействии штормов и биоэрозии от воздействия организмов- сверлильщиков и скоблящих фитофагов, таких как морские ежи и рыбы-попугаи (Сrook et al., 2013).
Растущий массив данных указывает на снижение скорости кальцификации кораллов в Мировом океане за последние 2 десятилетия на 15-30%, что связывают с двумя глобальными факторами: температурным стрессом и/или окислением океанской воды (De’ath et al., 2009; Маnzello et al., 2013). Более того, показано, что повышение температуры оказывает синергичное воздействие вместе с повышением рС02 на кораллы и кораллиновые водоросли, ускоряя ответную реакцию в виде обесцвечивания и последующей высокой смертности (Аnthony et al., 2008). Повышение рС02 и понижение рН разрушает фотозащитные механизмы коралловых эндосимбионтов и хлоропластов кораллиновых водорослей, снижая скорость фотореспирации и способность к рассеиванию тепловой энергии, и тем самым аккумулирует и усиливает температурный стресс в условиях аномально высоких температур окружающей среды (Аnthonu et al., 2008).
При сохранении нынешней скорости повышения концентрации СО2, к 2050 г. его уровень достигнет 560 ppm, что вызовет снижение концентрации карбонат-ионов ниже 200 ммоль/кг, при которой прирост карбонатного каркаса прекратится, и большинство рифов войдут в фазу растворения рифогенного известняка (Ноegh-Guldberg, 2007; Veron, 2011). Это будет сопровождаться сильнейшим обесцвечиванием и смертностью кораллов, глобальным уменьшением биоразнообразия, интенсивным разрушением трехмерной структуры рифов, минимальным развитием кораллиновых водорослей (Veron, 2008). Деградации подвергнутся и большие глубоководные биогермы, сформированные агерматипными рифообразующими кораллами с известковым скелетом (Veron, 2011). При текущих условиях возрастания концентрации СО2, самые худшие сценарии прогнозируют к 2100 г.: достижение уровня СО2(аtm) 800 ppm и выше и понижение рН морской воды на 0.3-0.4 единицы от 8.1 до 7.8-7.7, соответственно уровень насыщения арагонита Ωагag, снизится на 50% от 4 (при нынешних 390 ррm) до 2.1 (IРСС, 2007; Doney et al., 2009). В этом случае все современные коралловые рифы станут исключительно геологическими структурами с глобальным вымиранием рифообразующих кораллов (Veron, 2008, 2011; Veron et al., 2009). На экспериментальных полигонах in situ в районах вулканических выходов углекислого газа и пониженного рН показано, что прирост известкового каркаса рифа полностью прекращается при понижении рН до 7.7 (СО2, = 980 ррm) и Ωаrag до 2 (Fabricius et al., 2011). Другие работы (Ноеgh-Guldberg et al., 2007) прогнозируют еще более низкий терминальный порог для развития коралловых рифов, которое прекращается при достижении СО2(аtm) 480 ррm, Ωагаg 3.3 и концентрации карбонат-ионов 200 ммоль/кг. В геологической хронологии коралловые рифы сокращали или прекращали свое развитие в периоды, когда концентрация СО2, была как повышенной, так и пониженной, хотя вымирание кораллов при повышенной С02 было наиболее очевидным (Veron, 2011).
Несмотря на значительные адаптивные способности коралловых рифов (Donner et al., Hoegh-Guldberg et al., 2007), реальных рефугиумов для коралловых сообществ от комбинированного воздействия повышения температуры и океанского окисления не существует (Ноoidonk et al., 2014). Растворимость карбоната кальция увеличивается с продвижением в высокие широты, соответственно уменьшается Ωаrag. Диапазон изменения Ωаrag на маргинальных коралловых рифах у границ их широтного распространения такой, что снимает любые преимущества от пространственного положения этих рифов, способствующего меньшему воздействию температурных стрессов (Нооidonk et al., 2014). Более высокий уровень рС02 в высоких широтах может увеличивать чувствительность кораллов к повышению температуры и вызывать реактивный выброс эндосимбионтов, таким образом, маргинальные рифы могут обесцвечиваться быстрее, чем прогнозируется (Аnthony et al., 2008).
С другой стороны, регионы к северу от 8° широты подвержены сильным тропическим циклонам и штормам. Учитывая, что окисление воды может снижать плотность и прочность коралловых скелетов (Fabricius et al., 2011), в недалеком будущем маргинальные рифы в более высоких широтах будут иметь меньшую способность к восстановлению от физических разрушений, вызванных волновым воздействием.
Снижение способности к восстановлению будет критическим фактором в условиях прогнозируемого увеличения частоты тропических циклонов с глобальным изменением климата (Еmanuel, 2005). Наконец, реколонизация за счет молодых колоний сеголеток на маргинальных рифах будет медленной, гак как такие колонии могут испытывать больший стресс от низкого Ωаrag, чем взрослые многолетние колонии (Аlbright, 2011), хотя есть и альтернативное мнение (Сhua et al., 2013).
Наиболее устойчивы к понижению рН массивные кораллы из рода Роrites, способные выдерживать рН < 7.7 и Ωаrag < 2. однако при этом скорость кальцификации у них снижается в 2.5 раза, а степень биоэрозии возрастает на 80%. B сообществах коралловых и скалистых рифов морей тропических и умеренных широт увеличение С02 выше 750 ррm вызывает фазовый сдвиг в доминантах экосистемы и монополизации субстрата либо неизвестковыми макроводорослями и морскими травами, активно растущими в такой среде, либо бентосными беспозвоночными, нс имеющими развитого известкового скелета, такими как некoторые мягкие кораллы и актинии.
Выдвинута интересная “гипотеза обнаженных кораллов” (Stanley, Fautin, 2001). которая предполагает существование кораллов без известковых скелетов в периоды глобального океанского окисления, с этой гипотезой согласуется способность двух современных средиземноморских кораллов Осиlina patagonica и Маdracis pharensis терять свой скелет при экспозиции в аквариуме с низким рН и восстанавливать его при возвращении в нормальную морскую воду (Fine, Tchernov, 2007).
Сохранение биоразнообразия коралловых рифов будет зависеть от видоспецифичной способности кораллов к адаптации в быстро окисляющемся океане. Однако порог в 350 ррm С02(аtm), который не должен превышаться для нормального развития коралловых сообществ (Veron et al., 2009), уже преодолен, и только титанические совместные усилия всех стран по снижению выбросов углекислого газа в атмосферу могут предотвратить или хотя бы замедлить неизбежную экологическую катастрофу.
Болезни кораллов
Обесцвечивание кораллов может быть вызвано множеством стрессовых факторов, таких как высокие температура и освещенность (см. выше), низкая соленость (Goreeau, 1964), повышение седиментации (Реters, 1984, Rogers, 1990) и различные микробные инфекции (Rosenberg et al., 2008). Однако остается открытым вопрос — что вызывает массовое обесцвечивание, когда потеря пигмента происходит сразу у многих колоний равномерно по всей площади, а что является причиной возникновения пятен или полос обесцвеченной мертвой ткани на здоровой колонии. Большинство биологов считает, что температура и свет непосредственно оказывают влияние на ингибирование фотосинтеза за счет выброса зооксантелл и образования токсичных кислородных радикалов, приводящих к обесцвечиванию. В соответствии с этой гипотезой микроорганизмы не влияют на начало обесцвечивания и изменения в составе микробного сообщества у поврежденных депигментированных кораллов являются следствием, а не причиной обесцвечивания (Jones et al., 1998).
Альтернативная “микробная” гипотеза обеcцвечивания. наоборот, предполагает, что высокие температуры действуют как на сообщества микроорганизмов, так и на коралла-хозяина, и что именно микроорганизмы прямо или косвенно выpывают обесцвечивание (Rosenberg et al., 2008). В норме в комплексном сообществе (холобионте) коралла-хозяина, эндосимбиотических водорослей и микроорганизмов, населяющих коралл, метаболизм каждого организма направлен на рост, размножение и защиту от патогенных инвазий. При воздействии высоких температур равновесие между компонентами кораллового холобионта нарушается, что приводит к уменьшению зооксантелл, увеличению концентрации некоторых видов бактерий и потере антибактериальных свойств коралла-хозяина.

Acropora palmata с участками, поражёнными белой оспой (фото James W. Porter / University of Georgia)
Болезнь кораллов определяется как процесс повреждения мягких тканей или изменение физиологических функций, сопровождающихся видимыми симптомами (Rosenberg et al., 2008). К настоящему времени выделяют не менее 18 различных видов болезней у кораллов, причем только у 10 из них установлена этиология (Sutherrland et al., 2004; Weil et al., 2006). Патогенами кораллов являются несколько родов цианобектерий, бактерий из родов Vibrio и Serratia, вирусов, плесневых грибков, протистов, а также зеленая микроводоросль рода Епtocladia (Weil et al., 2006). Эти возбудители вызывают изменение цвета и лизис тканей кораллов, а также различные опухолевые новообразования, сопровождающиеся характерными симптомами, по которым заболевания получили свое название: болезнь “черной полосы”, “желтой полосы”, “красной полосы”, “белой полосы”, “белой чумы”, «белой оспы”, “желтой сыпи”, “пятнистого некроза” и др. Восприимчивость кораллов к различным патогенным возбудителям возрастает при воздействии стрессовых факторов, из которых повышение температуры воды считается наиболее существенным и в значительной мере способствует распространению всех известных болезней кораллов.
Инвазиям подвержены не только кораллы, но и другие группы организмов, играющие важную роль в экосистеме коралловых рифов, в частности кораллиновые водоросли, цементирующие рифовый каркас. Для индо-пацифической кораллиновой водоросли Роrolithon onkoides были описаны 2 типа летальной “оранжевой болезни”, вызванной неопределенным патогеном грибкового происхождения (Littler M., Littler D., 1998). До начала нового столетия большинство сообщений о возбудителях болезней кораллов приходились на Карибский регион (Goreau et al. 1998), однако позже было показано, что число и частота эпизоотий у кораллов Индо-Пацифики гораздо выше, чем считалось ранее (Sutherland et al., 2004).
Карибский регион стал наиболее показательной акваторией, где вспышки эпизоотий с начала 1980-х гг. привели к каскадным экологическим изменениям в динамике, функционировании и структуре коралловых рифов как в локальном, так и в региональном масштабе. В результате как прямых инвазий, результатом которых стало 16 типов различных поражений кораллов, так и непрямых эпизоотий (бактериальное поражение ключевого фитофага в регионе — морского ежа Diadema antillarum, вызвавшее массовую смертность и фазовый сдвиг от кораллов к водорослям на многих коралловых рифах) произошло грандиозное снижение кораллового покрытия в регионе (Wilkinson, 2004). Также эти инвазии способствовали изменению статуса ранее доминирующих видов кораллов, таких как два вида карибских акропорид Асropora palmata и А. сеrvicornis на статус “находящихся под угрозой исчезновения” (Вruckner et al., 2002). Распространение эпизоотий связывают с изменениями температуры воды и антропогенной эвтрофикацией, так как увеличение концентрации биогенов в значительной мере усиливает вирулентность патогенов. Эффективность передачи патогенов и заражения склерактиний может увеличиваться из-за изменения гидрологического режима, вызванного реконструкцией береговой линии (Касzmarsky et al., 2005).
Микробную гипотезу обесцвечивания кораллов под влиянием аномальных температур подтверждает феномен, носящий название “трансфоpмация Джекила и Хайда” (Rosenberg et al., 2008; Boroujerdi et al., 2009). Это изменение метаболизма бактерии Vibrio coralliilyticus при повышении температуры воды выше 24°С, увеличивающее ее патогенность и превращающее из безопасной в вирулентную для кораллов форму. V. coralliilyticus стала причиной отмирания мягких тканей, последующего обесцвечивания и гибели кораллов на Большом Барьерном рифе, в Индийском океане и Красном море. Другие представители бактерий рода Vibrio также усиливают свою вирулентность под воздействием высоких температур, что становится причиной массовой смертности склерактиний как в Карибском бассейне (Сеrvino et al., 2004), так и в Средиземном морс (Кushmaro et al., 1997). Таким образом, даже если температурная аномалия не имела немедленной ответной реакции у кораллов, она может проявляться опосредованно через повышение вирулентности микроорганизмов и снижение устойчивости кораллов к их патогенному воздействию, что повышает степень риска коралловых рифов, периодически подвергающихся температурным стрессам.
Тропические циклоны и штормы
Тропические циклоны (ураганы и тайфуны) и штормы являются наиболее очевидными и частыми естественными разрушителями коралловых сообществ, воздействуя как на их структуру, так и функционирование. При штормовых разрушениях важнейшими действующими факторами являются механический удар волны, ломающий кораллы, известковые водоросли и перемешивающий обломки, а также взвешенные в турбулентных потоках воды твердые частицы, которые как наждак срезают мягкие ткани с фрагментов кораллов, препятствуя их регенерации и вызывая гибель фрагментированных колоний (Преображенский, 1986). Целый массив наблюдений в разные годы свидетельствует о значительных снижениях кораллового покрытия или тотальном уничтожении всех живых колоний кораллов в результате штормовых воздействий. Разрушения могут охватывать всю мелководную часть рифа или группы рифов до глубин 10 и более метров. Наибольшие разрушения волновое воздействие оказывает на ветвистые и пластинчатые формы кораллов, ломая колонии и перемещая обломки на большие расстояния. Устойчивость колонии к отрыву от субстрата более зависит от прочности прикрепления к твердой поверхности, чем от размера и формы колонии или силы волновой энергии (Ваird et al., 2005).
На восстановление рифа после разрушительных ураганов уходит в среднем от 10 до 25 лет (Соnnell, 1997), хотя в отдельных случаях до полного восстановления кораллового сообщества может потребоваться значительно больше времени — от 40 лет в случае экспоненциального развития до 70 лет в случае линейного развития (Dollar, Trible, 1993). Восстановлению коралловых сообществ после гидродинамических воздействий препятствует влияние сопутствующих циклонам стрессовых факторов (Маllin, Corbett, 2006):
1) распреснение после дождей поверхностного слоя и увеличение концентрации биогенов, вызывающих бурное цветение водорослей и увеличение числа поражений кораллов микробными патогенами;
2) снижение концентрации кислорода в придонном слое, вызывающее замор беспозвоночных и рыб;
3) береговые смывы химических загрязняющих веществ и твердого мусора, оседающего на кораллах.
Температурный стресс и антропогенное истощение группы фитофагов, регулирующих рост водорослей, являются дополнительными факторами, ингибирующими восстановление механических разрушений кораллов (Вуthell et al., 2000).
Подавляющее большинство тропических циклонов формируется между 10-м и 30-м градусами широты обоих полушарий, причем 87% всех тропических циклонов — не далее 20-х градусов широты от экватора (Нenderson-Sellers et al., 1998). Частота и интенсивность ураганов во многих районах будет только увеличиваться в связи с глобальными изменениями климата. Это будет вести к сокращению времени для восстановления коралловых экосистем между повторами ураганов (Нughes et al., 2003). Только в Карибском бассейне в период с 1980 по 2001 год с воздействием ураганов связывают снижение кораллового покрытия на 17% (Gardner et al., 2005).
Показано, что тропические циклоны с ливневыми дождями и усилением пресноводных терригенных стоков в условиях глобального окисления океана могут приводить к периодам значительного локального снижения насыщения арагонита с пиковыми значениями Ωаrag < 1, что к концу этого века может стать обычным явлением даже при умеренных тропических циклонах (Маnzello et al., 2013). Таким образом, при прохождении циклонов коралловые рифы будут испытывать тройной стресс — от динамического разрушения волновой энергией, засыпания и абразии песком и мелкими обломками, и от последующего резкого снижения ΩСаС03, ингибирующего регенерацию уцелевших коралловых фрагментов.
Седиментация и эвтрофикация
Активное индустриальное освоение морского побережья по всему миру в виде дноуглубительных работ, строительства дорог, аэропортов, курортных и портовых зон, различных волноломных укреплений, искусственных островов, вырубки прибрежных лесов, мангровых зарослей и эрозии почвы значительно изменяет естественный режим осадконакопления в акваториях и увеличивает концентрацию взвеси в воде в десятки раз. Воздействие циклонов с проливными дождями на прибрежные районы также вызывает многократное увеличение содержания взвешенных частиц в воде. Такие изменения ведут к увеличению мутности воды, снижению количества света, необходимого для фотосинтеза симбиотических микроводорослей, и усилению седиментационной нагрузки на кораллы.
В результате происходит значительное или даже катастрофическое снижение кораллового покрытия и видового богатства, чему свидетельствует огромное количество примеров со всего мира (Rogers, 1990; Fabricius, 2005). Средняя скорость седиментации для рифов, не подверженных антропогенному воздействию, составляет от менее 1 до 10 мг/см2/ сут. (<10 мг/л); хроническое превышение этих концентраций считается высокой седиментацией (Rogers, 1990).
Повышение содержания взвешенного и аккумулированного на дне осадка становится причиной гибели в результате абразии и засыпания колоний, либо приводит к негативным последствиям, таким как замедление или прекращение линейного роста кораллов в результате снижения фотосинтеза из-за недостатка физиологически активной радиации (ФАР) и затрат на самоочищение (Rogers, 1990; Nugues, Rogers, 2003). Подвижный субстрат ингибирует оседание и закрепление коралловых планул и увеличивает их смертность, а повышенная мутность, снижающая количество ФАР, сдвигает нижнюю границу вертикального распределения кораллов выше в мелководную часть акватории.
Усиление седиментации способствует повышению биоэрозии, так как энергия, затрачиваемая на избавление от частиц с поверхности коралла, и ресурсы, уходящие на регенерацию мягких тканей, ослабляют коралл и делают его более уязвимым для инвазий сверлильщиков (Масdonald, Реrrу, 2003, Fabricius, 2005). Организмы-сверлилыцики могут достигать плотности нескольких тысяч экз./м2, ослабляя известковый скелет колоний и общий каркас рифа и делая их уязвимыми для механических повреждений, в первую очередь, при штормовой нагрузке (Fabricius, 2005). Основные группы макросверлильщиков составляют губки Сliona spp., двустворчатые моллюски Litophaga spp. и черви сипункулиды; к микросверлильщикам относятся сверлящие микроводоросли и бактерии (Масdonald, Реrrу, 2003, Fabricius, 2005).
Способность к самоочищению у кораллов видоспецифична и зависит от величины полипа и щупалец, толщины слизистого слоя, который смывается вместе со связанными в нем частицами осадка, морфологии колонии (формы роста) и некоторых физиологических реакций (Rogers, 1990). Многие виды кораллов имеют мощный мышечный и ресничный аппарат и, выделяя большое количество слизи, способны за несколько часов сбросить с себя большие массы песка и обломков (Преображенский, 1986). Таким образом, высокая седиментация не всегда приводит к снижению кораллового покрытия и деградации экосистемы. На примере кенийских коралловых рифов у устьев рек с увеличенным выносом осадка было показано, что в охраняемых от рыболовства акваториях при устойчиво высокой плотности популяций рыб-фитофагов, контролирующих развитие макроводорослей, коралловое покрытие может сохраняться на высоком уровне фактически без изменений многие годы (МсСlanahan et al., 2002). Изменения в коралловых сообществах происходят только в видовом составе в сторону более устойчивых к седиментации видов кораллов. Более того, повышенная седиментация также отрицательно воздействуют на ранние стадии развития макроводорослей (МсСlanahan et al., 2002).
Не менее интересный эффект оказывает взвесь при температурных аномалиях. Как полевые наблюдения (МсСlanahan et al., 2002), так и экспериментальные данные (Аnthony et a., 2007) показывают, что высокая концентрация взвешенных частиц в воде может снижать смертность кораллов за счет увеличения рассеивания солнечной радиации, в первую очередь, губительного ультрафиолетового излучения. Кроме того, выживанию обесцвеченных кораллов, лишенных автотрофного питания, может способствовать расширение альтернативного пищевого источника (увеличение концентрации зоопланктона). Таким образом, седиментация не всегда отрицательно влияет на коралловые экосистемы.
С усилением седиментации часто связана и эвтрофикация, особенно если речь идет о смывах азото-фосфорных удобрений с полей, попадающих вместе с речными и дождевыми выносами взвеси на коралловые рифы. Отдельно влияние эвтрофикации можно рассматривать в случаях хронического воздействия необработанных канализационных стоков или деятельности плавучих ферм марикультуры. Увеличение концентрации растворенных биогенов снижает гаметогенез у кораллов, развитие и оседание планул, снижает плотность планул и увеличивает смертность молоди кораллов, а также увеличивает плотность организмов-свсрлильщиков и патогенов, вызывающих специфические болезни кораллов (МсСоок et al., 2001; Fabricius, 2005). Отмечена значительная корреляция плотности сверлильщиков с содержанием биогенов в районах канализационных стоков и выносов удобрений. Здесь она может быть в 5-10 раз выше, чем в незагрязненных районах (Sammarco, Risk, 1990; Fabricius, 2005). Такая концентрация сверлильщиков в конечном итоге может приводить к фазе, когда биоэрозия рифа превышает карбонатно-кальциевый прирост и формирование рифового каркаса.
Более того, усиление эвтрофикации способствует развитию других фотосинтезирующих пространственных конкурентов склерактиний, таких как макроводоросли, актинии и кораллиморфарии, более устойчивые к повышенной седиментации и усиливающие интенсивность размножения и рост с увеличением концентрации биогенов. Хроническое загрязнение биогенами может вызывать многолетний коллапс коралловой экосистемы с отсутствием восстановления кораллов в течение десятилетий даже после прекращения эвтрофикации акватории и снижения концентрации биогенов (Соnnell, 1997).

Гроза кораллов зелёная водоросль Chlorodesmis fastigiata. Для борьбы с ней на рифах должны обитать её специфические фитофаги — бычки Gobiodon histrio и Paragobiodon echinocephalus.
Седиментация и эвтрофикация становятся губительными для кораллов при длительном воздействии и высоких концентрациях, а также при нарушении естественных механизмов регулирования роста водорослей с изменением качества воды. Наибольшая доля коралловых рифов, которые подвержены таким воздействиям, находится в странах Юго-Восточной Азии, где антропогенное изменение прибрежных территорий привело к кардинальным изменениям в режимах седиментации и эвтрофикации (Вurke et al., 2002; Wilkinson, 2004). Например, в заливе Нячанг центрального Вьетнама усиление седиментации и эвтрофикации, а также нерегулируемая эксплуатация рифовых ресурсов, в частности рыб-фитофагов, на некоторых рифах привели к снижению кораллового покрытия с 50-70% до 5-7%, а видового богатства склерактиний — в 7 и более раз (Павлов и др., 2004; Латыпов. 2006).
Типы фазовых сдвигов и роль функциональных групп в коралловых сообществах
Основным экологическим фактором, который обусловливает способность рифов к восстановлению, является сбалансированное биологическое и функциональное разнообразие (Nyström, Folke, 2001). В экологических исследованиях коралловых рифов последнее время все чаше используется оценка биоразнообразия и количественных характеристик функциональных групп вместо простого учета кораллового покрытия или встречаемости отдельных видов (Bellwood et al., 2004). Функциональные группы кораллов соответствуют их жизненным формам: ветвистые, пластинчатые, массивные, субмассивные и корковые (Bellwood et al., 2004), все они имеют значительные отличия по жизненным стратегиям и реакциям на негативные факторы. Кроме того, соотношение этих жизненных форм в рифовой экосистеме определяет степень развития се трехмерной структуры, от которой зависит наличие убежищ для огромного количества кораллобионтов и коралловых рыб, что в свою очередь определяет общее биоразнообразие сообщества. Изменение баланса, уменьшение доли чувствительных к стрессовым факторам жизненных форм и упрощение структуры рифа влечет за собой общее снижение биоразнообразия.
По морфологии и роли в функционировании коралловых экосистем водоросли можно разделить на три основных типа: корковые известковые, макроводоросли и водорослевый торф, которые по-разному взаимодействуют со склерактиниями (Steneck, 1988; Steneck, Dethier, 1994). Корковые известковые водоросли оказывают положительное воздействие на развитие кораллов, так как они являются основным цементирующим элементом рифового каркаса и благоприятным субстратом для развития осевших коралловых планул. Не- известковые зеленые, красные и бурые макроводоросли являются прямыми пространственными конкурентами кораллов на рифе. Водорослевый торф (многовидовое скопление преимущественно нитевидных водорослей высотой до 1 см (Steneck, 1988) способствует аккумулированию и связыванию на дне большого количества осадка, угнетающего развитие кораллов.
Фазовый сдвиг от доминирования рифообразующих кораллов к доминированию макроводорослей является одним из наиболее распространенных и хорошо изученных на коралловых рифах. Многократное увеличение обилия макроводорослей и зарастание ими кораллов происходит, как правило, под влиянием двух основных пусковых факторов: значительного снижения фитофагов (рыб и беспозвоночных), регулирующих обилие водорослей, и увеличения концентрации биогенов в воде. В недалеком будущем актуальным станет и третий глобальный фактор, способствующий доминированию макроводорослей — увеличение рС02 Макроводоросли занимают твердый субстрат и препятствуют закреплению коралловых планул и их развитию.
Водоросли не являются единственными пространственными конкурентами кораллов, которые в условиях меняющейся среды обитания становятся причиной деградации коралловых сообществ на больших площадях. Растет число сообщений о фазовых сдвигах от сообществ твердых кораллов к сообществам бесскелетных шестилучевых кораллов из отрядов Соrallimorpharia или Асtiniaria, мягких восьмилучевых кораллов (Norström et al., 2009); обыкновенных губок и в единичных случаях — колониальных асцидий (Ваk et al., 1996).
Можно выделить следующие преимущества для бесскелетных шестилучевых кораллов перед склерактиниями:
1) скорость размножения и роста как кораллиморфарий, так и актиний несравненно выше таковой у мадрепоровых кораллов, продукция которых в значительной степени расходуется на формирование известкового скелета;
2) представители обоих отрядов обладают маргинальными щупальцами с увеличенным числом нематоцистов, которые служат для контактного агрессивного воздействия на соседей;
3) кораллиморфарии могут образовывать сплошной покров из десятков сотен особей благодаря слиянию краевых участков оральных дисков. Актинии также могут образовывать плотные скопления. Таким образом, и те и другие оккупируют свободный твердый субстрат и ингибируют оседание, закрепление и развитие планул мадрепоровых кораллов;
4) кораллиморфарии способны убивать колонии контактирующих с ними склерактиний и быстро оккупировать их мертвые известковые скелеты как свободную твердую поверхность;
5) антропогенная эвтрофикация акваторий способствует увеличению скорости размножения актиний и кораллиморфарий, что в случае масштабных стрессовых воздействий на мадрепоровые кораллы (тайфун, температурная аномалия и т.д.) ускоряют фазовый сдвиг к доминированию бесскелетных кораллов;
6) бесскелетные шестилучевые кораллы более устойчивы к повышенной седиментации, чем склерактинии;
7) кораллиморфарии и актинии менее чувствительны к температурным стрессам благодаря утолщенной эндодерме, защищающей симбиотические зооксантеллы, лучшей фотоадаптации к солнечной радиации и способности к более быстрому, чем у склерактиний, восстановлению эндосимбионтов после температурного воздействия;
8) у кораллиморфарий и актиний меньше естественных врагов, чем у мадрепоровых кораллов. К ним относятся некоторые виды голожаберных моллюсков, морская звезда Сиlcita, морская черепаха бисса (Еretmochelys imbricata). Для этих видов не характерны плотные скопления или вспышки численности, в отличие от видов, питающихся полипами мадрепоровых кораллов (морская звезда Асаnthaster planci и гастропода Drupella spp.).
Некоторые виды губок (Demospongidae) также могут успешно конкурировать с кораллами, используя аллелопатическое воздействие, и, как результат, обрастать кораллы, приводя к их гибели (Сhadwick, Morrow, 2011). В отличие от водорослей, которые являются непосредственными конкурентами кораллов в хорошо освещенных местах, губки, как гетеротрофные фильтраторы. успешно конкурируют с кораллами только в сильно эвтрофированных акваториях с высокой мутностью и низкой освещенностью (Fabricius, 2005). Однако из этого правила есть исключения.
Так, корковая губка Теrpios hoshinota (Наdromerida: Suberitidae), содержащая цианобактерии в своих тканях, стала угрозой фактически для всех видов мадрепоровых и некоторых гидроидных кораллов в различных, преимущественно олиготрофных акваториях Индо-Пацифики в хорошо освещенных мелководных местах. При контакте с коралловой колонией токсины цианобактерий, содержащихся в этой губке, вызывают быстрое отмирание живых тканей коралла, после чего скелет колонии полностью покрывается черной и тонкой (менее 1 мм) тканевой пленкой губки. Причины быстрого распространения губки Теrpios остаются неясными.
Мягкие восьмилучевые кораллы являются типичными представителями коралловых сообществ как в Индо-Пацифике, так и в Карибском бассейне и при определенных обстоятельствах, спровоцированных стрессовыми факторами, снижающими покрытие твердых кораллов, может происходить фазовый сдвиг к доминированию мягких кораллов преимущественно из родов Sinularia, Sarcophyton, Хеnia и Аlcionium (Наумов и др., 1985; Вuckley et al., 2005; Fox et al., 2003). Однако стадия доминирования восьмилучевых кораллов, как и стадия доминирования губок в коралловом сообществе, может носить временный характер в ходе восстановительной сукцессии рифового сообщества в сторону доминирования склерактиний (Наумов и др., 1985). Это происходит, если стрессовое воздействие имело разовую, а не длительную хроническую природу (Соnnell, 1997).
Функциональная значимость рыб и крупных беспозвоночных в коралловой экосистеме определяется их принадлежностью к трем основным трофическим группам: (Grimsditch, Salm, 2006; Вellwood et al., 2004):
1) фитофаги, осуществляющие контроль роста водорослей на рифе;
2) хищники, способствующие сохранению высокого разнообразия фитофагов и регулирующие обилие рифовых биодеструкторов (морских ежей, рыб-попугаев, сверлящих губок и моллюсков);
3) кораллофаги, зависящие от фактического состояния и обилия кораллов в плане доступности пищи и количества естественных убежищ (Ткаchenko, Soong, 2010). Кроме того, рыбы-кораллофаги способствуют распространению симбиотических водорослей.

Акула чернопёрая рифовая (Мальгашская ночная, Carcharhinus melanopterus), один из основных хищников островов Лайн.
Истощение функциональных групп как пелагических фитофагов (рыб), так и бентосных фитофагов (морских ежей и некоторых гастропод), кардинально снижает или даже прекращает восстановление коралловых сообществ после разного рода разрушений (Bellwood et al., 2004). Морские ежи на коралловых рифах в зависимости от численности могут играть две существенно разные роли — от позитивной, как регуляторы обилия макроводороелей, до негативной, как биодеструкторы карбонатного каркаса рифа.
Широко известное массовое вымирание морского ежа Diadema antillarum в 1983-84 гг. во многих районах Карибского бассейна в результате инвазии патогенного возбудителя привело к разрастанию макроводорослей па коралловых рифах и резкому снижению покрытия рифообразующих кораллов (Lessios et al., 1984; Hughes et al., 1999). D.antillarum был основной функциональной группой фитофагов в коралловых экосистемах этого региона, контролирующих обилие макроводороcлей после многовекового антропогенного истощения альтернативной группы рыб-фитофагов. Популяция D.antillarum до сих пор восстанавливается очень медленно, что сказывается на общей региональной деградации коралловых рифов, которой способствует увеличение частоты ураганов и температурные аномалии в регионе.
С другой стороны, увеличение плотности популяций морских ежей вызывает существенное уменьшение карбонатно-кальциевого каркаса рифа в результате выедания цементирующего слоя корковых известковых водорослей и разрушения элементов рифовой структуры, включая слабо закрепленные коралловые колонии. Кроме того, диадемы могут питаться ювенильными колониями живых кораллов (Norström et al., 2009). Например, многократное увеличение плотности ежей Diadema mexicanum (до 20-50 экз./м2) привело к фазовым сдвигам от коралловых сообществ к “ежовым пустошам” в восточной Пацифике после массового вымирания кораллов в результате воздействия Эль-Ниньо в 1983-1984 гг. (Glynn, 1994; Eakin, 1996), а на рифах Кении нерегулируемое рыболовство способствовало увеличению численности диадем и значительному снижению кораллового покрытия.
Таким образом, вспышка численности ежей диадем в результате антропогенного изъятия из пищевой цепи плотоядных хищников (в первую очередь спинороговых рыб), и, как следствие, снижение кораллового покрытия, показывает важность сохранения баланса на всех уровнях пищевых звеньев и роль хищников в коралловых экосистемах. Показано, что изъятие хищников высшего порядка, таких как рифовые акулы, в результате избирательного рыболовства способствовало фундаментальным изменениям в структуре пищевых цепей на коралловых рифах (Ruppert et al., 2013). Это выражалось в увеличении численности некоторых плотоядных рыб, таких как луциановые, и снижении численности крупных растительноядных рыб, таких как скаровые, играющих ключевую роль в регулировании баланса между водорослями и кораллами в сообществе.
С другой стороны, интенсивное размножение хищников средних уровней пищевых цепей также может иметь негативные последствия для коралловых экосистем. Например, антропопогенная инвазия скорпеновой рыбы крылатки (Pterois volitans) в Карибский бассейн с последующей вспышкой ее численности привела к каскадным изменениям в видовом составе и обилии локальных ихтиофаун, в том числе и к значительному снижению рыб-фитофагов, регулирующих баланс между водорослями и кораллами на рифах (Albins, Hixon, 2008). Осложняет ситуацию из-за многолетнего и интенсивного перелова фактическое отсутствие в большей части региона крупных груперов — естественных врагов крылаток.
Функциональная группа плотоядных беспозвоночных-кораллофагов, основу питания которых составляют коралловые полипы, в значительной мере может определять статус кораллового сообщества и становиться причиной массовой смертности кораллов. Печально знаменитая морская звезда Асапthaster planci (“терновый венец”) стала темой многих исследований благодаря лавинообразным вспышкам численности, которые, начиная е 70-х годов прошлого столетия, периодически приводят к катастрофическим опустошениям на коралловых рифах Индо-Пацифики от Красного моря до о-вов Французской Полинезии.
При вспышках численности плотность популяции акантастера доходит до 100-1000 экз./га. Скорость потребления коралловых полипов одной взрослой особью акантастсра (> 40 см в диаметре) в зависимости от сезона составляет 161-478 см2/день или от 6 до 17 м2 живых тканей кораллов в год (Вirkeland, Lukas, 1990). Поэтому в периоды вспышки численности воздействие акантастсра может приводить к уничтожению до 95% покрытия рифообразую- щих кораллов. Причины массового размножения акантастера остаются малоизученными. Одна из причин — эвтрофированис в результате терригенных дождевых выносов, увеличивающих концентрацию фитопланктона — кормовую базу для личинок морских звезд (Brodie et al., 2005; Fabricius et al., 2010). Регулярные нападения “тернового венца” на некоторые рифы приводят к заметному сдвигу видового состава кораллов в сторону резистентных к этой звезде видов, таких как некоторые массивные поритиды, субмассивныс поциллопориды, восьмилучевые кораллы Heliopora coerulea, Tubipora spp., и гидрокоралл Мillepora sрр. (Преображенский, 1986).
Другой хищник-кораллофаг — гастроиода Drupella cornus на некоторых рифах западной тропической Пацифики может образовывать скопления до 175 экз./м2, вызывая гибель кораллов и снижая общее коралловое покрытие более чем вдвое, особенно на рифах с доминированием акропор (Turner, 1994). Приуроченность друпелл к кораллам из рода Асrороrа возможно связана с оптимальным сочетанием множества естественных убежищ и доступности пищи для друпелл в акропорах по сравнению с другими видами кораллов (Schoepf et al., 2010). Вспышки численности друпеллы коррелируют с факторами, ослабляющими выживаемость склерактиний, такими как усиление заиливания и механические повреждения колоний кораллов, а также с переловом рыб-бентофагов, в рацион которых входят друнеллы (Тurner, 1994).
Химическое загрязнение
Из антропогенных загрязнений наиболее частым и хорошо изученным является загрязнение нефтепродуктами при добыче нефти на шельфе в районах формирования рифовых систем, крушении нефтеналивных танкеров, промывке судовых топливных баков, попадании нефтепродуктов в воду из прибрежных транспортных трубопроводов. Нефтяное загрязнение действует одновременно на верхние и нижние этажи рифового сообщества, выводя его из равновесия на долгий срок и ингибируя его развитие (Loya, Rinkevich, 1979, 1980; Преображенский, 1986). Воздействие нефтепродуктов на кораллы многопланово. Оно приводит: 1) непосредственно к повреждению ценосарка, что вызывает защитное выделение большого количества слизи, приводящее к размножению патогенных бактерий и отмиранию мягких тканей кораллов; 2) замедлению роста гонад и гаметогенеза; 3) снижению выживаемости коралловых планул, их доли в спате и способности к оседанию и закреплению; 4) нарушению гетеротрофного питания кораллов, снижая численность планктонных организмов, которыми питаются кораллы. Дисперсанты, которые используются для расщепления нефтяных пятен, не менее вредны для кораллов, чем сырая нефть, так как ингибируют развитие планул, снижают их плавательные способности, способствуют морфологической деформации планул и деградации мягких тканей кораллов (Shafir et al., 2007).
Фактически все терригенные смывы загрязнены пестицидами, которые оказывают негативное воздействие на кораллы даже в малых концентрациях. Фунгициды влияют на все жизненные стадии кораллов: ингибируют оплодотворение и метаморфоз, снижают фотосинтез и запускают сброс зооксантелл, приводя к обесцвечиванию (Маrkey et al., 2007). При концентрации гербицида диурон 10 мг/л различные виды кораллов в значительной мере обесцвечиваются, плодовитость снижается на 90%, после длительной экспозиции в такой концентрации некоторые кораллы теряют способность к гамегогенезу (Cantin, Negri, 2007). В антиобрастающих красках используется трибутилтин, цинк и медь, которые ингибируют метаморфоз коралловых планул, а связанные с донным осадком, при взмучивании, эти компоненты могут вызывать высокую смертность кораллов (Smith et al., 2003).
С 60-х годов прошлого столетия в странах Юго-Восточной Азии, особенно на Филиппинах. в Индонезии, Вьетнаме и островах Южно- Китайского моря, начали применять цианид для обездвиживания и сбора живой рыбы: сейчас этот способ активно применяется в восточной Африке и центральном Тихоокеанском регионе (Вurke et al., 2002). Различные исследования показали, что цианид оказывает токсический эффект не только на рыб. но и на кораллы, кроме того, сам процесс ловли парализованной цианидом рыбы, которая прячется в расщелинах и коралловых укрытиях, обязывает сборщиков ломать кораллы молотком, чтобы достать рыбу. Экспозиция даже в течение короткого времени при концентрации цианистого натрия (NaCN), значительно меньшей, чем та, которая используются рыбаками для обездвижиания рыбы, приводила к необратимым физиологическим изменениям у кораллов и их высокой смертности (Сervino et al., 2003). Несмотря на то, что номинально такой способ рыболовства запрещен фактически во всех странах, высокая цена на живую рыбу, слабые охранные мероприятия и коррупция местных органов власти способствовали распространению этого метода на большей части коралловых рифов планеты, особенно в развивающихся странах со слабой экономикой.
Механическое разрушение кораллов человеком
По степени механического разрушения коралловых сообществ человеческую деятельность можно разделить на 3 основных типа: 1) непосредственная добыча кораллового известняка и полное разрушение как живого кораллового покрытия так и рифогенного каркаса; 2) деструктивная рыбалка с использованием динамита, в результате которой уничтожается коралловое покрытие от отдельных участков, до отдельных рифов в зависимости от нагрузки; 3) бесконтрольный туризм, включающий повреждения кораллов при дайвинге, снорклинге и использовании якорей на рифах.
Прямая добыча для строительных нужд как цельных блоков кораллового известняка, так и отдельных кораллов для измельчения, наземного сжигания и получения извести проводится в некоторых тропических регионах с историческим дефицитом строительных материалов. Например, на Мальдивских островах добыча известняка с коралловых отмелей ведется с начала первых поселений на островах несколько веков назад, но в последние десятилетия на фоне быстрого роста населения она приобрела широкий масштаб. Изъятие кораллового известняка имеет несколько кардинальных последствий; изменяется гидродинамический и седиментационный режим: ослабляется барьерная защита островов от волнового воздействия и усиливается абразия песчаных берегов. Изъятие кораллов и разрушение местообитаний влечет за собой резкое снижение биомассы и разнообразия рыб и бентоса.
Измененный субстрат разрабатываемых отмелей становится непригодным для закрепления и развития коралловых планул, и восстановления коралловых сообществ фактически не происходит на протяжении 20 лет после остановки выемки известняка (Вrown, Dunne, 1988).
Рыбалка с использованием динамита наносит максимальные повреждения всей экосистеме: убивает или калечит не только рыбу, но и кораллы в радиусе взрыва. Многократное использование динамита на рифе приводит к разрушению всех взрослых коралловых колоний, являющихся не только основным компонентом рифового трехмерного каркаса, но и источником новых коралловых планул, в результате происходит каскадная деградация сообщества, ведущая к фазе коллапса (МсManus, 1997; Fox et al., 2000). При этом восстановления кораллов не происходит, так как обширные поля обломков перемещаются под действием волн и течений, что не позволяет выживать молодым колониям, а на месте кораллов развиваются эфемерные сообщества макроводорослей (Fox et al., 2000).
Несмотря на повсеместный официальный запрет на использование динамита при ловле рыбы, такой способ из-за его низкой себестоимости и быстрых результатов остается распространенным более чем в 30 странах Юго-Восточной Азии, Южной Пацифики. Восточной Африки и южной части Красного моря.
Заякоривание на рифах менее травматично для рифовых экосистем, чем добыча известняка или динамитная рыбалка, однако при длительном и частом воздействии его эффект значителен. Наибольшие разрушения якоря несут ветвистым и пластинчатым кораллам. При уларе якоря колония отламывается либо целиком, либо распадается на крупные фрагменты, у которых больше шансов на выживание, чем при разрушении колоний на мелкие обломки при динамитной рыбалке. Сейчас многие страны в районах частого посещения рифов туристами выполняют программы по постановке мертвых якорей и швартовых бочек для безъякорной швартовки ботов и соответствующего снижения механических разрушений рифа.
Развитие туризма и активного водною отдыха идет стремительно. На каждом морском курорте в районах расположения тропических коралловых рифов работает множество дайв-центров, предлагающих дайвинг и снорклинг. Многие некогда роскошные рифы, известные и популярные среди дайверов всего мира, существенно изменились как по коралловому покрытию, так и по обилию ключевых видов рыб и позвоночных, в первую очередь, морских черепах только благодаря интенсивной туристической эксплуатации. В странах, где дайвинг и снорклинг является одним из наиболее развитых и популярных видов туристической активности, например в Египте, интенсивное посещение коралловых рифов у Хургады, Сафаги и Шарм-Эль-Шейха и бесконтрольная деятельность подводных туристов привели к тому, что на некоторых рифах только за 9 лет эксплуатации покрытие твердых кораллов снизилось более чем на 40%, в то время как покрытие мягких кораллов увеличилось на 100%, а водорослей — на 400% (Jameson 1999, 2007).
На рифах, находящихся вблизи курортов, может быть до 30 000 погружений (дайверов) в год, при каждом погружении происходит в среднем до 10 контактов с живыми кораллами в виде касания, взмучивания донного осадка, присыпания колонии или её непосредственного повреждения (Zakai, Chadwick-Furman, 2002). Наиболее подвержены механическим повреждениям хрупкие ветвистые кораллы. На рифах Эйлата в заливе Акаба Красного моря, часто посещаемых дайверами, ежегодная доля механических разрушений кораллов, вызванных действиями дайверов, в два раза больше, чем на нетронутых рифах, что приводит к значительному снижению скорости роста кораллов (Guzman et al., 2010).
Снорклинг наибольшее негативное воздействие оказывает на мелководную часть рифа в зонах риф-флета, лагун и рифового гребня, т.е. везде, где проплывающий в маске и ластах турист может вызвать механические разрушения ластами при движении, вставании на кораллы или неуклюжих контактах телом и руками. Так же как и при дайвинге, сильнее всего страдают хрупкие ветвистые, пластинчатые и листовидные формы кораллов, массивные и корковые формы более устойчивы к таким повреждениям (Наwkins, Roberts, 1992). Даже небольшое количество ныряльщиков (15 человек в неделю) может вызывать на конкретном маршруте за полгода увеличение количества обломков кораллов в 8 раз (Рlathong et al., 2000). Выживаемость небольших коралловых фрагментов очень низкая, большинство фрагментов нс успевают закрепиться, смываются с твердых поверхностей и захораниваются в подвижном осадке, особенно в районах, открытых для волнового воздействия (Кау, Liddle, 1989).
Создание морских охраняемых акваторий является ключевым фактором в сохранении биоразнообразия и устойчивости коралловых рифов. При глобальных природных стрессовых воздействиях такие резерваты, очевидно, не смогут предотвратить массовую гибель кораллов, однако сохранение функциональных групп фитофагов на высоком уровне и контроль других разрушающих антропогенных воздействий существенно поддерживают способность экосистемы к самовосстановлению (Еdwards et al., 2011).
Тем не менее эффективность этих резерватов до настоящего времени явно недостаточна. К настоящему времени создано около 650 морских охраняемых акваторий, охватывающих 8% существующих коралловых рифов. Однако почти половина охраняемых акваторий существуют только в постановлениях, а из 332 реальных морских резерватов только 14% управляются эффективно (Burke et al., 2002).
Заключение
В свете перечисленных экологических угроз существует несколько сценариев развития коралловых рифов в текущем столетии (рисунок). С высокой вероятностью можно полагать, что к середине текущего столетия экосистемы тропических коралловых рифов будут находиться в фазе коллапса (фаза “D” на рис.) более чем на 50% площади своего географического распространения.
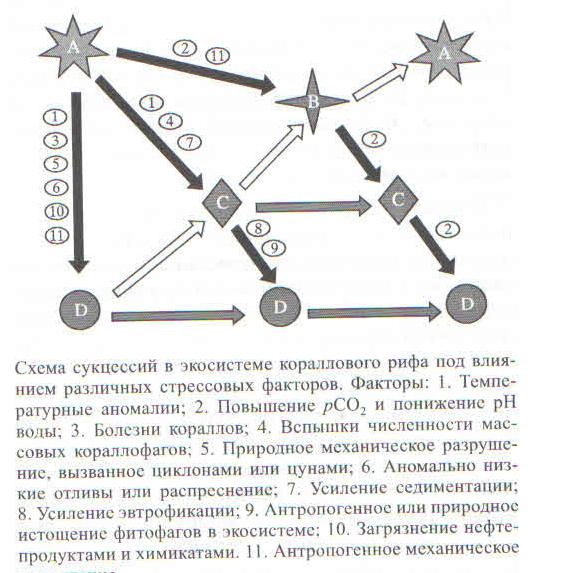
Сообщества: А- здоровое коралловое сообщество, представленное в основном взрослыми многолетними колониями быстрорастущих видов со сложными формами роста (ветвистые, кустистые, пластинчатые) и низкой стрессоустойчивостью; В — восстанавливающееся коралловое сообщество с теми же доминантами, что и в сообществе А, но представленное преимущественно молодыми колониями; С — коралловое сообщество, представленное склерактиниями с высокой стрессоустойчивостью и простыми формами роста (массивные и корковые); D — альтернативные сообщества, возникающие в результате фазовых сдвигов от доминирования склерактинний к доминированию макроводорослей. бесскелетных шестилучевых кораллов (актиний и кораллиморфарнн) или мягких восьмилучевых кораллов. Черный, серый и белый цвет стрелок означают соответственно деградацию, стабильность и восстановление коралловой экосистемы.
В первую очередь, коралловые сообщества исчезнут в районах с высокой плотностью поселений человека, где двум глобальным негативным факторам воздействия (аномальные температуры, уменьшение рН), содействуют антропогенное увеличение седиментации и эвтрофикации, нерегулируемая эксплуатация биоресурсов рифов и прямое механическое разрушение. К таким районам относится треугольник максимального видового разнообразия и происхождения современных кораллов в Юго-Восточной Азии, так же как и большая часть береговой линии материков. Больше шансов остается у коралловых рифов, находящихся либо в крупных и хорошо охраняемых морских заповедниках типа Большого Барьерного рифа, либо у наиболее удаленных и слабозаселенных островов, которых тоже немного. Но и там восстановление коралловых рифов после температурных аномалий может ингибироваться неизбежным повышением рСО2, и периодическими механическими разрушениями в результате штормов и циклонов.
В результате комплексного воздействия анализируемых здесь стрессовых факторов при оптистичном сценарии сообщества склерактиний в некоторых акваториях сохранятся, но после глобальных трансформаций в них будут преобладать наиболее устойчивые таксоны, такие как корковые и массивные формы медленно растущих видов с высокой конкурентоспособностью. Наиболее высокие показатели по этим признакам у представителей рода Роrites. В наиболее пессимистичном варианте сообщества склерактиний повсеместно будут замещены альтернативными сообществами макроводорослей, мягких восьмилучевых и бесскелетных шестилучевых кораллов (актиний и кораллиморфарий).
Источник Журнал общей биологии. 2015. Е.76. №5. С.390-414
P.S. На этом, мягко говоря, печальном фоне, Конференция по международной торговле видами, находящимися под угрозой исчезновения (CITES) отклонила предложение о контроле торговли кораллами, оставив их беззащитными. Это не первый такой случай — на фоне катастрофы сокола-балобана в Казахстане МСОП … снизил его статус с «угрожаемого» до уязвимого, а несколько ранее конференция CITES отказалась запретить промысел голубого тунца.
Это капитализм в действии, когда природоохранные организации прогибаются под нужды «больших денег». Или правительства, составляющие «Красные книги», особенно в странах зависимого развития вроде РФ; но и в США лобби природопользователей эффективно мешает включению в «Красную книгу» неудобного им шалфейного тетерева Centrocercus urophasianus, несмотря на обвальное сокращение численности и ареала.





















