marina_fr
«Можно ли предсказать предрасположенность человека к определённым болезням? Биологи и медики пытаются этого добиться. В последние несколько лет [текст 2011 г. — Публ.] получили широкое распространение так называемые genome-wide association studies (GWAS).
Подавляющее большинство генов человека уже известно, прочтена их нуклеотидная последовательность, причём не только кодирующая часть, но и находящиеся рядом с ней участки, которые могут играть какую-либо роль в регуляции активности гена. Стало возможным довольно быстро выяснить, какие именно мутации в определённых местах (локусах) отличают конкретных индивидов. Обычно исследователи фокусируются при этом на генах (не только их кодирующей, но и регуляторной части). Преимущественно их интересуют при этом точечные мутации, состоящие в замене одного нуклеотида на другой, более масштабные перестройки генома вроде, скажем, повторения участка, содержащего целый ген, изучаются реже.
Повторяющиеся некодирующие участки, в том числе находящиеся на концах хромосом и рядом с центромерой, практически выпадают из поля зрения генетиков. Это неудивительно – размер человеческого генома всё-таки три миллиарда нуклеотидов, всё не охватишь. А в повторяющихся участках и разобраться куда сложнее. Представьте себе, что вы пытаетесь сориентироваться на плантации, где рядами сидят ёлочки одного возраста – понять, где именно вы находитесь, невозможно.
Охвачены в GWAS оказываются тысячи людей, как здоровых, так и страдающих определёнными заболеваниями. Естественно, получающийся массив данных огромен. Но современные методы обработки информации позволяют после этого посмотреть, какие генетические варианты связаны с теми или иными болезнями, и насколько велик их вклад (если он есть, что надо смотреть отдельно — correlation is not causation) в повышение риска заболевания. См., например, Welcome Trust Control Consortium, 2007; Genuneit et al., 2011
Эти исследования уже дали много интересных результатов. Но выясняется, что существенная, часто бoльшая часть наследственной изменчивости остаётся необъяснённой, её нельзя пока приписать влиянию каких-то конкретных локусов. Дело в том, что методами классической генетики (исследования родственников, близнецов) уже был оценен вклад наследственности в предрасположенность к различным заболеваниям. И во многих случаях он должен быть существенно больше, чем следует из данных GWAS. Это явление получило название «missing heritability» или «hidden heritability». Оно наблюдается для множества уже давно изучаемых генетиками признаков – от роста до предрасположенности к шизофрении. Иначе говоря, возможности молекулярной биологии огромны, а результаты пока не так значительны.
Для «missing heritability» возможны несколько отнюдь не взаимоисключающих объяснений.
Во-первых, существенный вклад в наследственную изменчивость могут вносить не охваченные методом генетические вариации, например, отличия в межгенных областях, в многократно повторяющейся ДНК. Обычно неизученными оказываются также отличия по перестройкам крупных участков генома, скажем, вариации в числе копий гена, см., например, работу по генетике аутизма.
Во-вторых, даже на тысячах испытуемых статистика плохо работает с редкими генетическими вариантами, которые встречаются с частотой не 40% и даже не 5%, а вообще, возможно, всего несколько раз на выборку. Между тем именно среди них может быть много сравнительно «новых» мутаций, которые ещё не отсеяны естественным отбором и способны причинить существенный вред своему носителю.
В третьих, влияние нескольких генетических вариантов далеко не всегда можно просто суммировать, есть эффекты, связанные с их взаимодействием. Естественно, статистика способна оценить и эти эффекты, но необходимые для такой оценки выборки огромны.
В четвёртых, определённый наследственный вариант может оказывать значительное влияние на развитие заболевания, но влияние это будет разным в разных условиях.
Обзор C.Ober и D.Vercelli в №3 журнала Trends in Genetics за этот год посвящён одному из возможных объяснений этого явления – разному влиянию одного и того же генетического варианта на предрасположенность к болезни в разных условиях.
Проблема рассматривается авторами на примере астмы, заболевания, частота которого стремительно растёт сейчас в развитых странах, особенно с ростом урбанизации и вестернизации. Сейчас астмой болеют уже более 300 млн. людей во всём мире. Резкое учащение астмы и других аллергических заболеваний заставило занимающихся этой проблемой исследователей выдвинуть так называемую гипотезу «гигиены». В её современном виде гипотеза гигиены выглядит так. Есть разные пути развития иммунных реакций, связанные с разными типами лимфоцитов, продукцией разных типов антител и т.д. Между ними должен поддерживаться определённый баланс, если какой-то из путей начинает преобладать, то иммунный ответ становится неадекватным, могут развиться, скажем, аллергические болезни. Раньше баланс настраивался в раннем детстве, при контакте младенца с микробами, паразитами и другими источниками естественных антигенов. Нынешние младенцы со всем этим (включая и приятные вещи вроде парного молока) контактируют всё меньше. Баланс нарушается, например, при астме чрезмерен вклад в иммунный ответ лимфоцитов типа Th2. Иными словами, чистота – отнюдь не во всех отношения залог здоровья.
Раньше контакт младенца с кошками, собаками, животными на ферме вызывал у педиатра настороженности, даже если аллергических заболеваний у ребёнка пока не было. Теперь, наоборот, считается, что иметь домашнее животное для предотвращения этого рода болезней даже полезно. Но ведь у некоторых детей возникает аллергия на шерсть животных!
В чём тут дело? Во многих случаях, видимо – в генотипе конкретного ребёнка. Так, в ходе целого ряда исследований была установлена роль генетических вариантов в промоторе гена CD14, то есть в участке, с которого начинается его считывание. Этот ген работает в клетках иммунной системы. Различия в промоторной области не так велики – в определённом месте может стоять нуклеотид Т или нуклеотид С. Но один из вариантов способствует развитию астмы у детей, которые во младенчестве часто и помногу контактировали с животными, другой – у тех, которые с животными практически не контактировали. Если контакт был, но умеренный, то никакой связи астмы с генотипом по этому локусу не наблюдалось.
Подобные зависимости могут сильно «смазать» результаты даже массовых исследований. Например, исследование астмы у сельских детей центральной Европы не выявило тех закономерностей, которые были обнаружены в предыдущих работах, выполненных преимущественно на городских популяциях. Применяя более «мягкие» критерии достоверности, удалось-таки выявить локусы, влияющие на заболеваемость астмой. Для большинства из них характер влияния точно так же, как для вариантов в промоторе CD14, отличался в зависимости от того, контактировал ли младенец с животными.
Ещё один возможный источник несогласованности результатов, характерный для подобных исследований – статистика хорошо работает для вариантов, частота которых близка к 50%, и гораздо хуже – для всех остальных. При этом в разных популяциях частота тех же самых генетических вариантов может различаться. И статистика в одной популяции влияние заметит, а в другой – нет.
Столь же неоднозначным действием обладают варианты гена (HLA)-G при материнской астме (она в разной степени повышает вероятность астмы у ребёнка). Вариабельный нуклеотид (G или С) расположен уже не в промоторе, а на 3’-конце гена. Это тоже важный участок, где связываются регулирующие активность гена микро-РНК. Один из вариантов защищает от астмы детей больных матерей, но несколько повышает вероятность заболевания детей, мать которых здорова.
Другой провоцирующий астму фактор – табачный дым в доме. К сожалению, локусов, определённые варианты которых могут сделать вред от него вполне ощутимым, более чем достаточно. Тем не менее, относительная сила влияния просмолённой атмосферы зависит от генотипа младенца. Поэтому и появляются отговорки вроде «у N над колыбелькой дымили, а вырос здоровенький».
Во всех рассмотренных выше случаях мы встречаемся с «честной» генетической вариабельностью, пусть и неоднозначно влияющей на предрасположенность. Но не надо забывать, что иногда передача признаков от родителей потомству может происходить и за счёт эпигенетических механизмов, иначе говоря, не как результат вариаций самой последовательности нуклеотидов в ДНК.
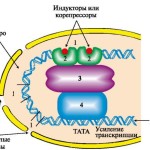
Один из таких механизмов – изменение уровня метилирования ДНК, то есть наличия добавочных метильных групп у определённых нуклеотидов. Во многих, хотя и не во всех случаях, метилирование гена, особенно его промоторных областей, снижает его активность. Оказывается, на этот процесс могут влиять и факторы окружающей среды. Скажем, диета. Ставить опыты на человеке, конечно, нельзя. Но вот у беременных мышей диета, содержавшая много доноров метильной группы, утяжеляла течение аллергических дыхательных заболеваний. Предрасположенность к развитию соответствующих заболеваний передавалась и потомству. При выяснении того, метилирование каких генов оказывает это вредное влияние, исследователи особо выделили роль гена транскрипционного фактора Runx3. Транскрипционные факторы играют ключевую роль в регуляции активности генов большого числа генов сразу. А Runx3 влияет и конкретно на развитие дыхательных аллергий.
Итак, астма даёт нам хороший пример того, что при изучении генетики распространённых заболеваний человека не следует забывать о взаимодействии наследственных и средовых факторов.
Via wolf_kitses
Поэтому сейчас полезность GWAS оказывается под вопросом (точней — эффективность, соотношение между результатом, достаточно неопределённым, и затратами, весьма значительными)
Биологи усомнились в пользе широкомасштабных генетических исследований
Содержание
Генетики из Стэнфордского университета предположили, что ценность широкомасштабных генетических исследований, целью которых является поиск ассоциаций между наследующимися признаками или болезнями и однонуклеотидными полиморфизмами, возможно, преувеличена. Вместо того чтобы тратить ресурсы на анализ все больших выборок пациентов, ученые предлагают сконцентрироваться на расшифровке внутриклеточных регуляторных сетей. Статья опубликована в журнале Cell, а с комментариями авторов можно ознакомиться в заметке в Nature.
Полногеномный поиск ассоциаций (GWAS — Genome-Wide Association Studies) — это направление генетических исследований, которое устанавливает связь между какими-либо признаками и генетическими маркерами. В роли последних чаще всего выступают однонуклеотидные полиморфизмы (SNP — Single-Nucleotide Polymorphisms), то есть варианты в последовательности ДНК, которые встречаются в популяции достаточно часто (более чем у одного процента людей). Исследования основаны на сравнении геномов группы людей, обладающих заданным признаком или страдающим каким-либо заболеванием, с контрольной группой. На основании статистической обработки частот встречаемости тех или иных вариантов в двух группах делается вывод о том, что вариант X (например, нуклеотид A в последовательности гена) ассоциирован с признаком Y (например, ожирением).
Подобные исследования получили распространение с увеличением доступности анализа последовательностей ДНК и за последние десять лет существенно набрали обороты. Если в первых статьях на тему генетических ассоциаций анализировались выборки в несколько сотен человек, то в 2017 году приличным размером выборки считается 200 тысяч и более. К примеру, в исследовании диабета второго типа, проводимом Оксфордским Университетом, участвует миллион человек. Такие объемы данных необходимы, чтобы сделать выводы более надежными и учесть большее количество генетических вариантов.
Благодаря широкомасштабным исследованиям было получено большое количество ценных данных. Разные варианты белков, участвующих в метаболизме лекарств в печени, подсказали медикам, что пациенты могут по-разному отвечать на препараты, и в некоторых случаях дозу нужно варьировать индивидуально. Другие исследования позволили уточнить механизм развития болезней, к примеру, учесть вклад центральной нервной системы в развитие наследственного ожирения.
Однако, несмотря на очевидную пользу генетических ассоциаций, чаще всего их результаты трудно поддаются интерпретации. Большинство обнаруженных вариантов имеет очень слабую, хотя и статистически достоверную связь с заданным признаком. Из наличия связи еще не следует механизм, по которому ген X влияет на признак Y. Зачастую X относится к факторам, которые на первый взгляд вообще никак не относятся к Y. Грубо говоря, из широкомасштабных исследований может следовать вывод, что «все влияет на все».
Генетики из Стэнфорда предложили критический взгляд на полногеномный анализ ассоциаций и повторно проанализировали некоторые опубликованные исследования на эту тему. К примеру, взяв данные из работы 2014 года, посвященной генетике такого сложного признака, как рост, авторы обнаружили, что с ростом так или иначе ассоциированы 62 процента всех полиморфизмов человека, хотя достоверную связь можно установить только для трех процентов. Каждый из полиморфизмов условно вносит вклад в рост в полтора миллиметра.
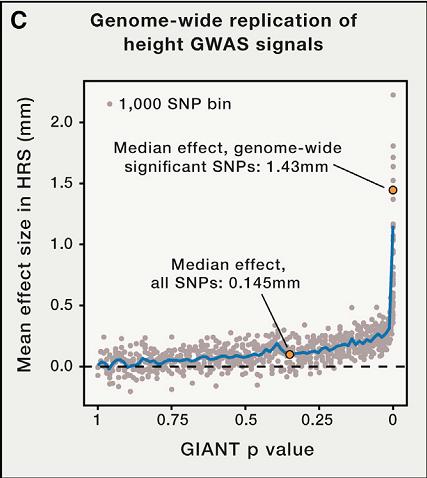
Ассоциации полиморфизмов (SNP) c ростом. По оси X величина, отражающая достоверность связи варианта с признаком (чем она меньше, тем лучше). Boyle et al. / Cell 2017
Также генетики изучили данные для шизофрении и двух аутоиммунных наследственных заболеваний — ревматоидного артрита и болезни Крона. Для всех трех заболеваний имеются генетические ассоциации с изменением экспрессии генов в специфических тканях (в нейронах для шизофрении и органах иммунитета для аутоиммунных заболеваний). Однако ученые обнаружили, что больший вклад в генетику этих расстройств вносят полиморфизмы, расположенные просто в активно работающих областях генома, а не в конкретных тканях.
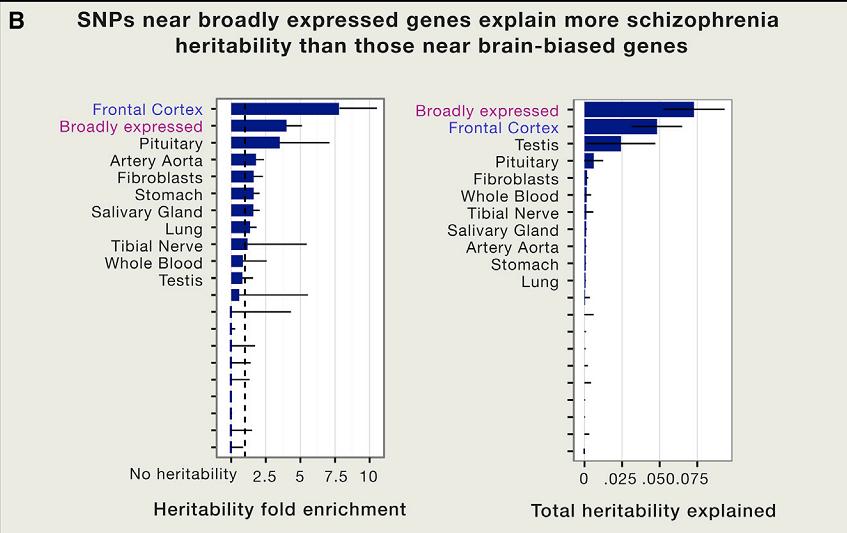
Графики, отражающие вклад полиморфизмов, влияющих на экспрессию генов в отдельных тканях или в целом в активно считываемых участках генома. Boyle et al / Cell 2017Т
Таким образом, вклад конкретного генетического варианта чаще всего является косвенным. Например, полиморфизм может влиять на работу регуляторного комплекса, который контролирует сотни генов, а какие-то из них уже могут быть непосредственно связаны с заболеванием или другим признаком. Исходя из этого, авторы статьи предлагают признать, что в реальности все влияет на все, и перейти от концепции «мультигенных» признаков к «всегенной» [омнигенной, см.ниже] концепции. Чтобы интерпретировать уже собранные данные, нужно сосредоточиться на анализе внутриклеточных регуляторных сетей, а не проводить новые, еще более масштабные исследования. Только так можно понять, почему вариант X ассоциирован с признаком Y, и сделать практические выводы, считают генетики.
Авторы работы напоминают, что в случае мультифакторных признаков вклад генетических маркеров по отдельности рассматривать нельзя. Они имеют ценность только в виде суммы множества небольших изменений. Ведется поиск полногеномных ассоциаций даже с такими сложными признаками, как репродуктивное поведение и интеллект.
Источник — n+1
P.S. публикатора.
Меня спрашивали, «почему этих проблем метода не видели и не решили раньше»? Я думаю, тут проблема как с биологизаторством: в качестве первого шага (эмпирическое обобщение, что с чем связано) оно вполне разумно и правильно, но на втором (поиски, через что влияет и как) становится уже вредным. А не все могут вовремя переориентироваться, тем более что подход первого шага уже развился в значительную индустрию, умеющую привлечь к себе деньги и внимание общества. Инерция, усиливаемая рыночными механизмами, как в собственно экономике так и в коммуникации учёных с обществом.
Омнигенная модель: что если любой ген влияет почти на все?
В 1999 году одна научная группа проштудировала геномы полутораста пар сестер и братьев в попытке отыскать гены, вызывающие аутизм, но ничего у них не вышло. По мнению ученых, это связано с тем, что риск аутизма не определяется жалкой кучкой мощных генов, которые возможно было выявить в ходе исследования, а скорее зависит от большого количества генов, каждый из которых производит небольшой эффект. Таких генов 15 или побольше, прикинули ученые.
Как наивны они были. Сегодня их прикидки выглядят до абсурдного ничтожными. Подзовите к себе ближайшего к вам генетика и скажите ему, что рост, вес или другая физическая характеристика, риск рака, шизофрении или другого заболевания зависят от 15 генов, – он рассмеется вам в лицо и назовет шутником. Современная наука полагает, что такие сложные черты – это результат совместной работы тысяч генов, подавляющее большинство из которых оказывают незначительное влияние в одиночку, но вместе производят колоссальное воздействие на наше тело и его здоровье.
При этом считается, что эти гены объединяются в кластеры, которые посредством биохимических реакций напрямую связаны с той или иной чертой или болезнью. Например, генные варианты (полиморфизмы), связанные с ростом, влияют на гены, контролирующие развитие костей, а варианты, связанные с шизофренией, воздействуют на гены, работающие в нервной системе. Таким образом, для каждого гена, участвующего в формировании какой-либо особенности, можно проследить молекулярные пути, которыми он с ней связан. Такова примерная суть полигенной модели, принятой в современной генетике.
Однако все это верно лишь отчасти, считают специалисты из Стэнфордского университета (США), ведущий из которых – профессор Джонатан Притчард. Да, есть определенные ключевые гены, которые следуют описанной схеме, и в том, какими путями они воздействуют на ту или иную особенность организма, можно усмотреть биологический смысл. Но гены не работают в изоляции друг от друга – они влияют друг на друга в обширных генных сетях, и если какой-нибудь вариант внесет изменения в работу одного из генов, то это может изменить работу всей сети. И такие сети настолько тесно переплетены друг с другом, что практически любой ген отделен от любого другого гена небольшим количеством звеньев биохимической цепи. Это фактически означает, что изменения в любом гене сказываются на работе ключевых генов для конкретного состояния или характеристики организма.
Такой взгляд на работу генов авторы окрестили омнигенной моделью. Согласно ей, большинство генов имеют значение для большинства признаков. Если конкретнее, то все гены, которые включаются в определенных клетках – скажем, в нейронах или кардиомиоцитах, – вероятно, оказывают влияние почти на каждый сложный признак, связанный с этими клетками. То есть, например, почти каждый ген, работающий в нейронах, играет какую-то роль в определении интеллекта, склонности к обучению, риска деменции. Какие-то из генов, несомненно, на ведущих ролях, другие – на втором плане, третьи – в эпизодах, четвертые – камео. И лишь немногие сидят в зрительном зале и не принимают участия в постановке.
Вот почему поиск вариантов генов, отвечающих за сложные признаки, столь труден [см. рассказ про исследование GIANT выше]….
Свидетельства в пользу омнигенной модели были получены и в результате анализа крупных генетических исследований ревматоидного артрита, шизофрении и болезни Крона. Многие из генных вариантов, выявленных в этих работах, действительно относятся к рассматриваемым заболеваниям – например, некоторые шизофренические полиморфизмы влияют на гены, участвующие в работе нервной системы. Однако в большинстве своем влияние затрагивает гены, которые едва ли можно увязать с нужными заболеваниями. Согласно омнигенной модели, это не более чем случайное влияние, которое накладывается на эффекты ключевых генов, тем не менее оно вносит свой вклад в определение риска заболевания.
«Это единственная модель, которую я могу предложить и которой удовлетворяют все данные», – говорит Притчард.
Если дядька прав, то большая часть генных вариантов, на крупномасштабные поиски которых вбухивают огромные деньги в надежде, что они как-то объяснят наши болезни, на самом деле ничего не объяснят. В лучшем случае они поаплодируют из-за кулис основному составу, занятому на сцене, что, несомненно, важно для атмосферы, но ничего не говорит о самом действе. Гораздо полезнее вычислять сети ключевых генов, работающие в разных клетках, и их редкие варианты, которые могут оказывать значительное влияние на организм. Но если на данном этапе развития генетики даже уточнение роли одного гена в какой-либо болезни считается большим успехом, то как можно охватить пониманием целые комбинации из сотен и тысяч взаимодействующих друг с другом генов?»
Источник batrachospermum