Наездник Cotesia flavipes — один из многих тысяч видов паразитических наездников, которые выводят из строя защитные системы своих жертв при помощи «ручных» вирусов. Фото с сайта www.uky.edu
В продолжение темы природной генной модификации
Наездники подавляют иммунную защиту своих жертв при помощи прирученных вирусов
Содержание
Александр Марков
Паразитоидные наездники — одна из самых разнообразных групп насекомых, включающая десятки тысяч видов. Они играют огромную роль в природных экосистемах, а также в сельском хозяйстве, контролируя численность растительноядных насекомых, в том числе многих вредителей сельскохозяйственных культур. Личинки наездников развиваются в теле жертвы, пожирая ее заживо. В свое время эта необычайная «жестокость природы», возможно, повлияла на мировоззрение Чарльза Дарвина, который заметил в одном из писем, что не может себе представить, как мог благой и милосердный Создатель такое сотворить (причем не единожды, а в десятках тысяч вариаций, как мы могли бы сейчас добавить).
Многие наездники впрыскивают в жертву, кроме своих яиц, также и особые вирусоподобные частицы. Их называют поли-ДНК-вирусами (Polydnavirus, PDV). Оболочка PDV очень похожа на оболочку других вирусов насекомых (особенно бакуловирусов, см.: Насекомые-вредители защищаются от биологического оружия, «Элементы», 08.10.2007), однако генетическая «начинка» у них совсем другая. Каждый PDV содержит несколько маленьких кольцевых молекул ДНК с генами белков, подавляющих защитную реакцию организма хозяина (например, гусеницы). Это позволяет личинкам наездника беспрепятственно развиваться в теле жертвы.
При этом, в отличие от всех нормальных вирусов, PDV не содержат специфических вирусных генов, необходимых для размножения. Поэтому PDV не могут размножаться в организме гусеницы. Не размножаются они и в организме наездника. По сути дела, они вообще не размножаются. Новые PDV образуются только в яичниках самки наездника. Яичники синтезируют PDV точно так же, как любой орган многоклеточного животного синтезирует различные вещества и молекулярные комплексы для внутреннего использования или выведения наружу.

Личинки наездника Cotesia congregata окуклились на выеденной ими изнутри гусенице бабочки Ceratomia catalpae. Фото с сайта www.marietta.edu
Эти удивительные особенности поли-ДНК-вирусов заставляли некоторых экспертов сомневаться в их вирусной природе. Может быть, PDV в действительности являются не вирусами, а специфическими молекулярными комплексами, возникшими в ходе эволюции наездников как одна из адаптаций к паразитизму? Может быть, их внешнее сходство с вирусами случайно?
Генетики из Франции и Швейцарии сообщили в последнем номере журнала Science, что им удалось разгадать загадку поли-ДНК-вирусов и доказать их происхождение от настоящего вируса, который некогда встроился в геном наездника и подвергся «одомашниванию» (о молекулярном одомашнивании см. в заметке: Растения заимствуют гены у «геномных паразитов», «Элементы», 26.11.2007).
Существует две группы PDV, приуроченные к двум семействам наездников: браконидам (браковирусы) и ихневмонидам (ихновирусы). Главным объектом исследования стал PDV из первой группы, синтезируемый наездником Cotesia congregata (Cotesia congregata bracovirus, CcBV), а также два других вида наездников, производящих PDV.
«Геном» CcBV, то есть тот генетический материал, который находится в вирусоподобной частице, состоит из 30 кольцевых двухцепочечных ДНК общей длиной 560 000 пар нуклеотидов (что сравнимо с самыми маленькими бактериальными геномами). Эти молекулы ДНК кодируют белки-иммуносупрессоры, совершенно не похожие на белки известных вирусов. Кольцевые «хромосомы» CcBV изготавливаются из копий фрагментов геномной ДНК наездника.
Гены, необходимые для образования CcBV, в том числе гены белков оболочки этого псевдовируса, отсутствуют в его «геноме». Это, однако, еще не доказывает, что CcBV и другие поли-ДНК-вирусы не являются потомками настоящих вирусов. Чтобы выяснить происхождение PDV, нужно было найти гены, управляющие созданием вирусных частиц. Ясно, что эти гены должны присутствовать в геноме наездника. Если окажется, что эти гены схожи с генами настоящих вирусов, это будет означать, что когда-то в геном наездника встроился вирус, который затем подвергся «одомашниванию». Вирусные гены впоследствии перестали включаться в состав вирусной частицы, но по-прежнему управляют ее формированием.
Поэтому первая задача, которую поставили перед собой исследователи, состояла в том, чтобы выяснить, есть ли в геноме наездника гены вирусного происхождения, которые могут обеспечить создание вирусных частиц. Причем эти гены должны работать (экспрессироваться) исключительно в яичниках, потому что известно, что ни в каких других органах наездника PDV не образуются.
Чтобы понять, какие гены работают в том или ином органе, из него выделяют матричные РНК (мРНК) — первичный продукт активности генов. Анализ мРНК, выделенных из яичников наездников-браконид, позволил выявить 22 активных гена вирусного происхождения, очень похожих на гены нудивирусов — сравнительно малоизученной группы вирусов насекомых.
Но может быть, исследованные наездники просто были заражены каким-то нудивирусом, и это его мРНК обнаружились в яичниках? Чтобы исключить эту возможность, исследователям пришлось отсеквенировать несколько больших фрагментов геномной ДНК наездника. В этих фрагментах обнаружилось 10 встроенных нудивирусных генов, причем пять из них образуют единый кластер (расположены вплотную друг к другу), а остальные разбросаны по геному.
Дальнейшие исследования показали, что экспрессия нудивирусных генов, встроенных в геном наездника, активизируется у самок на стадии куколки, то есть как раз тогда, когда происходит формирование вирусных частиц PDV. Гены работают не во всём яичнике, а только в стенках фолликулов — именно там, где формируются PDV.
Чтобы исключить последние сомнения, авторы исследовали непосредственно сами белки, входящие в состав оболочек PDV (это технически намного сложнее, чем определять последовательность нуклеотидов в ДНК и РНК). Оказалось, что как минимум шесть из этих белков являются продуктами нудивирусных генов, встроенных в геном наездников-браконид.
Полученные результаты убедительно показали, что поли-ДНК-вирусы браконид являются потомками настоящих вирусов из группы нудивирусов, которые когда-то встроились в геном этих наездников. Вирусы подверглись «одомашниванию», их гены рассеялись по геному наездников и перестали включаться в вирусные частицы, но по-прежнему продолжают работать, обеспечивая сборку этих частиц, которые наполняются теперь совсем другой генетической «начинкой».
Чтобы более детально воссоздать историю этого удивительного симбиоза насекомых и вирусов, авторы предприняли целенаправленный поиск двух наиболее консервативных (мало меняющихся в ходе эволюции) нудивирусных генов в геномах многих разных наездников-браконид, имеющих PDV. Эти наездники образуют монофилетическую (происходящую от одного предка) группу (ее называют «микрогастроидным комплексом») в пределах семейства браконид. К микрогастроидному комплексу относится свыше 17 000 видов наездников. Искомые гены обнаружились у всех исследованных представителей микрогастроидного комплекса.
Авторы пришли к выводу, что около 100 млн лет назад (в середине мелового периода, когда происходила быстрая сопряженная диверсификация цветковых растений и насекомых) в геном наездника — предка микрогастроидного комплекса — встроился нудивирус, который вскоре был одомашнен и стал помогать наездникам справляться с иммунной системой гусениц. Симбиоз с вирусом оказался настолько выгодным, что потомки этого наездника необычайно размножились и дали начало 17 тысячам современных видов.
Уже на самых ранних этапах эволюции симбиотического комплекса «начинка» вирусных частиц была заменена: теперь вместо вирусных генов в них стали упаковываться гены наездника. Любопытно, что в ходе дальнейшей эволюции микрогастроидного комплекса гены «начинки», отвечающие за обезвреживание защитных систем гусеницы, менялись гораздо быстрее, чем «одомашненные» нудивирусные гены, отвечающие за сборку вирусной частицы.
Что же касается ихневмонид — другой группы наездников, применяющих PDV для борьбы с иммунной системой своих жертв, — то в их геноме нудивирусных генов обнаружить не удалось. Авторы предполагают, что ихневмониды вступили в симбиоз с каким-то другим вирусом, относящимся к пока еще не открытой группе вирусов. Есть все основания полагать, что науке пока известна лишь небольшая часть реального разнообразия вирусов насекомых.
Исследование еще раз показало, что симбиоз — в том числе симбиоз животных с вирусами — является одним из важнейших путей формирования эволюционных новшеств. Область приложимости теории симбиогенеза продолжает расширяться.
Источник: Annie Bézier et al. Polydnaviruses of Braconid Wasps Derive from an Ancestral Nudivirus // Science. 2009. V. 323. P. 926–930.
Источник elementy.ru
Уникальный случай тройного симбиоза: вирус помогает бактерии защищать тлю от врагов
Александр Марков

Наездник Aphidius ervi откладывает яйцо в тлю Acyrthosiphon pisum. Фото из обсуждаемой статьи в Science
Опаснейшими врагами тлей являются наездники, личинки которых развиваются в теле тли, пожирая ее изнутри. «Защитная» симбиотическая бактерия Hamiltonella defensa, живущая в клетках некоторых тлей, вырабатывает токсины, смертельные для личинок наездников. Американские энтомологи экспериментально показали, что эффективную защиту тлей от наездников обеспечивают не любые бактерии H. defensa, а только зараженные вирусом-бактериофагом APSE. Гены токсичных белков, необходимых для уничтожения личинок наездника, находятся в геноме вируса, а не бактерии. Это один из первых описанных случаев, когда мутуалистические (взаимовыгодные) отношения двух организмов (в данном случае — тли и бактерии) обеспечиваются благодаря вирусу, выступающему в роли необходимого третьего компонента симбиотической системы.
Многие насекомые буквально нашпигованы различными симбиотическими микробами. Симбионты помогают своим хозяевам решать многие жизненные задачи: от синтеза незаменимых аминокислот и витаминов до переваривания химически чистой целлюлозы, фиксации атмосферного азота и борьбы с сорняками на грибных плантациях (см. ссылки внизу).
В круг задач, выполняемых бактериями — симбионтами насекомых, входит и защита хозяев от опаснейших паразитов — наездников (о наездниках см. в заметке: Тлевые наездники эффективнее паразитируют на тлях, когда у них разная пищевая специализация, «Элементы», 25.09.2008). Именно эту роль взяла на себя гамма-протеобактерия Hamiltonella defensa, обитающая в клетках многих насекомых, питающихся растительными соками, в том числе тлей. Гамильтонелла, как и многие другие внутриклеточные симбионты, наследуется по материнской линии в ряду поколений насекомых-хозяев (бактерия проникает в яйца, откладываемые зараженной самкой).
Ранее было замечено, что разновидности (штаммы) гамильтонеллы различаются по своим защитным свойствам: одни обеспечивают надежную защиту гороховой тли (Acyrthosiphon pisum) от наездника Aphidius ervi, убивая до 80–90% личинок паразита, тогда как другие защищают хозяина гораздо хуже или не защищают вовсе. Кроме того, обнаружилось, что защитные свойства гамильтонеллы коррелируют с зараженностью бактерии вирусом-бактериофагом, получившим название APSE (A. pisum secondary endosymbiont). Известно несколько разновидностей этого вируса, причем в геноме каждой разновидности содержатся гены белков, токсичных для животных. Было высказано предположение, что именно эти токсины, закодированные в вирусном геноме, используются симбиотическим комплексом «тля—бактерия» для борьбы с общим врагом — личинками наездника. Это предположение косвенно подтвердилось в ходе сравнения защитных свойств трех штаммов гамильтонеллы, два из которых имеют в своем геноме встроенный геном разновидности вируса APSE-3, а третий не заражен вирусом. Оказалось, что первые два штамма обеспечивают очень высокий уровень защиты тли от наездника, а третий не обладает этим свойством.
Этих данных, однако, было недостаточно для того, чтобы считать роль вируса APSE в защите тли от наездника доказанной. Дело в том, что в данном симбиотическом комплексе участвуют трое — тля, бактерия и вирус; у каждого из трех компонентов есть свой собственный геном, причем каждый из трех геномов существует в виде множества вариаций. Поэтому, например, если комплекс «тля + бактерия + вирус» защищен от паразитов, а комплекс «тля + бактерия» — нет, то причиной может быть не только присутствие или отсутствие вируса, но и генетические различия между штаммами (линиями, клонами) бактерий и тлей. В принципе, наличие вируса в геноме тех штаммов бактерии, которые защищают тлю от наездников, может оказаться случайным совпадением.
Чтобы строго доказать роль вируса во взаимовыгодном сотрудничестве бактерии и тли, нужно было получить генетически чистые линии тлей и бактерий, различающиеся только наличием или отсутствием в бактериальном геноме встроенного фага APSE.
Именно это и сделали американские энтомологи из университетов Джорджии и Аризоны, опубликовавшие результаты своих исследований в последнем номере журнала Science. Чистую линию (клон) генетически идентичных тлей получить нетрудно, так как тли способны размножаться партеногенетически: самки откладывают неоплодотворенные яйца, из которых вылупляются точные генетические копии матери. Нетрудно получить и генетически идентичных тлей, различающихся только наличием или отсутствием гамильтонеллы. Для этого достаточно «вылечить» часть клона от симбиотической бактерии при помощи антибиотиков. Намного труднее получить генетически идентичных бактерий, различающихся только наличием или отсутствием встроенного фага. Понятно, что никакими антибиотиками встроенный вирусный геном из бактериальной хромосомы не выскрести. И вот тут ученым просто повезло. Они обнаружили, что гамильтонеллы в череде поколений иногда случайно «теряют» встроенного фага в результате делеции (см. deletion).
Это позволило ученым вывести три линии генетически идентичных тлей:
1) с гамильтонеллой, зараженной вирусом APSE-3,
2) с точно такой же гамильтонеллой, но без вируса;
3) без гамильтонеллы.
Этих тлей отдавали «на растерзание» наездникам Aphidius ervi, которые откладывали в них свои яйца. Затем ученые подсчитывали в каждой из трех линий процент выживших личинок наездника (который равен проценту погибших тлей, так как в каждую тлю наездник откладывает одно яйцо, после чего выжить может только кто-то один: либо тля, либо личинка наездника).
В первой из трех линий личинки наездника сумели погубить лишь около 6% тлей, во второй и третьей — около 80%. Эти результаты доказывают, что вирус APSE действительно необходим для защиты тли от наездника.
Интересно, что содержание в своем теле защитных симбионтов не является «бесплатным удовольствием» ни для тлей, ни для бактерий. Ранее было показано, что при выращивании в лаборатории в отсутствие наездников тли, не зараженные гамильтонеллой, размножаются успешнее зараженных, и в результате со временем популяция тлей может полностью освободиться от бактерии. То же самое происходит и в паре «бактерия—вирус»: оказалось, что гамильтонеллы в лабораторных линиях полностью освобождаются от вируса за 3–4 года. Разумеется, ситуация меняется на обратную, если тли регулярно подвергаются нападению наездников. В этом случае естественный отбор благоприятствует как распротранению гамильтонеллы в популяции тлей, так и распространению вируса APSE в популяции гамильтонелл.
Ранее «Элементы» рассказывали о том, как Наездники подавляют иммунную защиту своих жертв при помощи прирученных вирусов («Элементы», 19.02.2009). Теперь выясняется, что в «эволюционной гонке вооружений» (evolutionary arms race) наездников и их жертв симбиотические вирусы участвуют в игре на обеих сторонах. Фактически, насекомые ведут друг с другом настоящую «вирусологическую войну».
Данное исследование интересно тем, что в нем впервые продемонстрирована роль бактериофагов в регулировании мутуалистических (взаимовыгодных) отношений между симбиотическими бактериями и их хозяевами. Ранее был уже описан случай, когда вирус делает возможным взаимовыгодное сотрудничество между грибом и растением (см.: Растение, гриб и вирус объединились, чтобы втроем противостоять высоким температурам, «Элементы», 29.01.2007), но у бактериофагов такие способности ранее не были известны. С другой стороны, известен ряд случаев, когда бактериофаги помогают патогенным бактериям (например, холерному вибриону) в их борьбе с защитными системами хозяев.
Исследование еще раз показало, что посредством вирусов бактерии могут очень быстро приобретать новые полезные для себя свойства. Это может иметь далеко идущие экологические последствия — особенно если бактерия вовлечена в тесные мутуалистические или антагонистические взаимоотношения с другими организмами. Не исключено, что та поразительная скорость, с которой насекомые приспосабливаются к новым условиям (например, к новым кормовым растениям) или вырабатывают устойчивость к ядам, отчасти объясняется деятельностью фагов, проводящих разнообразные генно-инженерные эксперименты на бактериях — симбионтах насекомых.
Источник: Kerry M. Oliver, Patrick H. Degnan, Martha S. Hunter, Nancy A. Moran. Bacteriophages Encode Factors Required for Protection in a Symbiotic Mutualism // Science. 2009. V. 325. P. 992-994.
Источник elementy.ru
Растение, гриб и вирус объединились, чтобы втроем противостоять высоким температурам
Александр Марков

Растение Dichanthelium lanuginosum прекрасно растет на почве, нагретой до 65°C, но погибает (справа) в тех же условиях, если его лишить симбиотического гриба Curvularia protuberata (фото с сайта wfrc.usgs.gov)
Термостойкая трава, растущая на горячих геотермальных почвах в Йеллоустонском национальном парке, обязана своей термоустойчивостью симбиотическому грибу. Ни гриб, ни трава по отдельности не выносят перегрева. Оказалось, что в этом симбиотическом комплексе есть еще и третий необходимый участник — вирус, живущий в клетках гриба. Гриб, «вылеченный» от вируса, теряет способность придавать термоустойчивость растению-хозяину.
Удивительный пример тройного симбиоза описали в последнем номере журнала Science американские биологи, работающие в Йеллоустонском национальном парке (США), где на горячей почве вблизи геотермальных источников произрастает термостойкая трава Dichanthelium lanuginosum, близкая родственница проса. Ранее было установлено, что удивительная устойчивость этого растения к высоким температурам каким-то образом связана с эндофитным (произрастающим в тканях растения) грибом Curvularia protuberata. Если выращивать растение и гриб по отдельности друг от друга, ни тот, ни другой организм не выдерживает длительного нагревания свыше 38°C, однако вместе они прекрасно растут на почве с температурой 65°C. Кроме того, даже в отсутствие теплового стресса растение, зараженное грибом, растет быстрее и лучше переносит засухи.
Авторы обсуждаемой статьи недавно предположили, что гриб помогает растению обезвреживать активные формы кислорода (АФК), образующиеся как побочный продукт реакции растения на стресс (об АФК см.: Ю. А. Лабас, А. В. Гордеева, Л. Г. Наглер. Незримое одеяние голых тварей // Природа, № 12, 2006). Действительно, у растений, лишенных симбиотического гриба, в условиях теплового стресса в листьях образуются заметные количества АФК, тогда как у растений с грибом этого не наблюдается.
Продолжая исследование этой удивительной симбиотической системы, ученые обнаружили, что в ней есть еще и третий обязательный участник — РНК-содержащий вирус, обитающий в клетках гриба. Авторы обнаружили вирус, выделив из клеток гриба две крупные молекулы двухцепочечной РНК, которые, собственно, и представляют собой геном вируса. Одна из молекул содержит два гена РНК-зависимых РНК-полимераз (см. Найден самый древний из ферментов, «Элементы», 11.12.2006). Эти гены обеспечивают репликацию (размножение) вируса. Вторая молекула двухцепочечной РНК также содержит два гена, функцию которых установить не удалось (они не похожи ни на один ген с известной функцией).
Исследователи выделили из гриба не только вирусную РНК, но и сами вирусные частицы. Они похожи на другие грибные вирусы и имеют вид шариков диаметром около 30 нанометров.
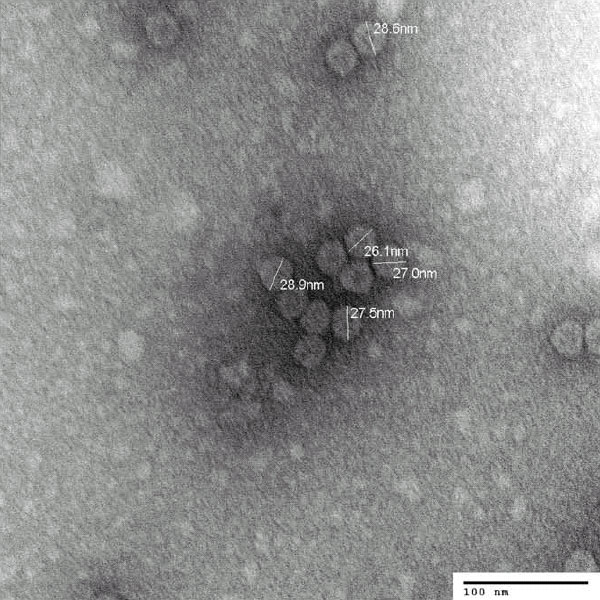
Вирусы, необходимые для термоустойчивости симбиотического комплекса, под электронным микроскопом (фото из дополнительных материалов к обсуждаемой статье в Science)
Ученые решили выяснить, не оказывает ли обнаруженный вирус какого-нибудь влияния на взаимоотношения гриба и растения. Для этого они «вылечили» гриб, подвергнув его мицелий высушиванию и замораживанию при –80°C. Эта суровая процедура приводит к разрушению вирусных частиц (и благо тем организмам, которые могут, как грибы, сами ее выдержать и таким образом исцелиться от вирусных болезней!).
Необходимые для экспериментов «безгрибные» растения получали из семян, с которых снимали оболочку, а затем полоскали 10–15 минут в хлорке. Выращенные из таких семян растения затем заражали (или не заражали) симбиотическим грибом, капая на них из пипетки взвесь грибных спор.
Оказалось, что гриб, «вылеченный» от вируса, не в состоянии сделать растение термоустойчивым. Растения с таким грибом погибали на горячей почве точно так же, как и растения без гриба.
Однако нужно было еще убедиться, что дело тут именно в вирусе, а не в каких-то побочных эффектах тех жестоких процедур, которые применялись при «лечении» гриба от вируса и растения — от гриба. Для этого «вылеченные» грибы были снова заражены вирусом, а этими повторно зараженными грибами, в свою очередь, заразили «вылеченные» растения. Теперь всё было в порядке: заново собранный симбиотический комплекс отлично рос на горячей почве.
Таким образом, для термоустойчивости оказались необходимы все три компонента симбиотической системы: и растение, и гриб, и вирус.
Правда, идея о ключевой роли активных форм кислорода не подтвердилась. Производство АФК в листьях одинаково снижалось у растений, зараженных любым грибом: с вирусом или без.
Напоследок ученые провели совсем уж смелый эксперимент, свидетельствующий о высоком полете творческой мысли: взяли да заразили «грибом термоустойчивости» совершенно другое растение, а именно обыкновенный помидор. Были взяты четыре группы молодых томатов, по 19 растений в каждой. Первую группу заразили «дикой» формой гриба, содержащего вирус; вторую — грибом, вылеченным от вируса, а затем снова зараженным; третью — грибом, лишенным вируса; четвертую вообще оставили без грибов. Затем почву, в которой росли эти помидоры, стали каждые сутки нагревать до 65°C на 10 часов, а остальные 14 часов температура почвы была 26°C. Спустя 14 дней в первой группе в живых осталось 11 растений, во второй – 10, в третьей – 4, в четвертой — только 2.
Таким образом, гриб, зараженный вирусом, способен повышать термоустойчивость не только у своего природного хозяина — однодольного растения Dichanthelium lanuginosum, но и у неродственных растений, относящихся к классу двудольных. Это открытие может иметь большое практическое значение. Трудность пока в том, что авторам не удалось добиться стопроцентной зараженности всех помидоров симбиотическими грибами. Именно этим, по их мнению, объясняется более высокая смертность подопытных томатов на горячей почве по сравнению с Dichanthelium lanuginosum.
Источник: Luis M. Márquez, Regina S. Redman, Russell J. Rodriguez, Marilyn J. Roossinck. A Virus in a Fungus in a Plant: Three-Way Symbiosis Required for Thermal Tolerance // Science. 2007. V. 315. P. 513–515.
Источник elementy.ru