В продолжение темы, что не так в асимметричных (они же социобиологические) моделях полового отбора
М. Н. Ерофеева, С. В. Найденко
Представлены данные о различиях во взаимоотношениях самцов и самок у кошачьих с разной степенью выраженности полового диморфизма размеров тела. Показано, что в период гона у евразийской рыси, вида с наименьшей выраженностью полового диморфизма, самки в значительной степени определяют характер взаимоотношений с партнером. Отмечено, что для них характерна большая частота проявления дружелюбного поведения и элементов ухаживания, тогда как частота агрессивных контактов очень низка. Установлено, что у видов с сильной выраженностью полового диморфизма характер взаимоотношений в период гона определяется в основном самцами.
У большинства млекопитающих половой диморфизм выражен достаточно сильно, в том числе и в размерах тела, как правило, самцы крупнее самок (Trivers, 1972; Andersson, 1994; Lindenfors et al., 2007).
Половой диморфизм связан со многими аспектами жизни животных: экологией, поведением, популяционной динамикой и эволюцией жизненных стратегий (Boonstra et al., 1993; Allaine et al., 1998; King, Allaine, 2002; Isaac, 2005; Pörschmann et al., 2010). Многие исследователи анализировали связь степени выраженности полового диморфизма и репродуктивных стратегий животных (Boonstra et al., 1993; Allaine et al., 1998; King, Allaine, 2002), сезонности и климатических условий (Loison et al., 1999; Storz et al., 2001; Issac, Johnson, 2003), плотности популяций изучаемых видов (Johannesen et al., 2000; LeBlanc et al., 2001).
Очень большое внимание было уделено изменению репродуктивного успеха в зависимости от степени выраженности полового диморфизма (Schulte-Hostedde et al., 2001; Pörschmann et al., 2010). Считается, что чем больше у конкретного вида выражен половой диморфизм размеров тела, смещенный у млекопитающих в сторону самцов, тем выше вариабельность в репродуктивном успехе самцов (Yamane, 1998; Pörschmann et al., 2010). У видов со слабо выраженным половым диморфизмом размеров тела или со смещенным в сторону самок наблюдается низкая вариабельность в успехе размножения отдельных самцов (Coltman et al., 1999; Schulte-Hostedde et al., 2004).
При этом крайне мало работ, в которых рассматриваются с точки зрения поведенческой экологии особенности выбора брачного партнера при разной степени выраженности полового диморфизма размеров тела. Известно, что более крупные самцы чаще спариваются с самками и имеют более высокий репродуктивный успех по сравнению с самцами меньшего размера (Yamane, 1998; Pörschmann et al., 2010). Остаются без ответов следующие вопросы: достигаются ли преимущества более крупными самцами при соперничестве с другими самцами того же вида? предпочитают ли самки более крупных самцов или, возможно, принимают их, поскольку это может снижать риск травм и повреждений при агрессивных контактах? При этом показано, что даже у полигинных видов степень выраженности полового диморфизма размеров тела может сильно варьировать из-за условий среды обитания (Schulte-Hostedde et al., 2004; Isaac, 2005; Kappeler, Fichtel, 2015), соответственно и вариабельность взаимоотношений у животных может быть очень велика.
Для разных представителей семейства кошачьих (Felidae) выраженность полового диморфизма в размерах/массе тела очень различается, варьируя от 2 (когда самец в 2 раза крупнее самки, как у золотой кошки Profelis aurata) до близкого к 1 (когда самец и самка почти одного размера, как у евразийской рыси Lynx lynx, гепарда Acinonyx jubatus и канадской рыси L. canadensis) (Гептнер, Слудский, 1972; Nowell, Jackson, 1996). Большинство кошачьих ведет одиночный образ жизни (Юдаков, Николаев, 1987; Poole, 1994; Sliwa, 2004; Grassman et al., 2005).
Особи, занимающие соседние территории, используют участки обитания, как правило, независимо одна от другой (Poole, 1995). Контакты с сородичами вне периода гона редки и непродолжительны (Seidensticker et al., 1973), чаще всего животные стараются избегать контактов со своими “соседями” (Hornocker, 1969). Для самки встреча с самцом, который значительно превосходит ее по размеру, даже в период гона может носить стрессирующий характер (Павлова, 2010). В случае большой разницы в размерах партнеров может увеличиваться риск получения травм самкой и невозможности успешного противостояния партнеру при агрессивных взаимодействиях. Это подразумевает снижение роли самок в выборе полового партнера.
На основе анализа репродуктивных стратегий кошачьих (Найденко, Ерофеева, 2004; Ерофеева, Найденко, 2011) была выдвинута гипотеза, что у видов со слабо выраженным половым диморфизмом в размерах тела самки будут определять характер взаимодействия партнеров в период гона. У видов же с большой степенью выраженности полового диморфизма в размерах тела в период гона характер взаимодействий животных определяется в основном самцами. Цель исследования – сопоставить социальное поведение в период гона у трех видов кошачьих с разной степенью выраженности полового диморфизма.
Материалы и методы
Были исследованы три вида семейства кошачьих Felidae. В качестве основных объектов исследований были использованы евразийская рысь L.lynx (вид с наименьшей выраженностью полового диморфизма – отношение массы самца и самки в среднем 1 (Котов, Рябов, 1963; Найденко, 2005)); домашняя кошка Felis silvestris var. сatus (вид со средней выраженностью полового диморфизма – отношение массы самца и самки в среднем 1.3 (наши данные; Jones, Coman, 1982)) и дальневосточный лесной кот Prionailurus bengalensis euptilura (вид с высокой выраженностью полового диморфизма –отношение массы самца и самки в среднем 1.5 (наши данные; Гептнер, Слудский, 1972)). Для евразийской рыси и дальневосточного лесного кота характерны схожие социальная и пространственная организации.
Это одиночные хищные млекопитающие (Гептнер, Слудский, 1972; Nowell, Jackson, 1996). Индивидуальные участки обитания самцов перекрываются частично или полностью с 2–3 участками обитания самок (Давыдов, 1983; Пикунов, Коркишко, 1992; Breitenmoser et al., 1993; Jedrzejewski et al., 1996). Для домашней кошки характерна высокая вариабельность в социальной и пространственной организациях. При разных условиях этот хищник может жить как одиночно, так и в больших социальных группах (Liberg, 1981; Pontier, Natoli, 1996; Say et al., 1999, 2002), а система размножения может варьировать от моногамии до промискуитета (Say et al., 1999).
Исследования проводили на научно-экспериментальной базе “Черноголовка” ИПЭЭ РАН, на коллекции животных ЦКП “Живая коллекция диких видов млекопитающих” в 2002–2018 гг. Всего использовали 12 самок и 6 самцов евразийской рыси, 7 самок и 7 самцов домашней кошки, 12 самок и 11 самцов дальневосточного лесного кота. За поведением всех исследуемых видов наблюдали в период эструса самок. Наступление эструса определяли по изменению характера взаимодействия самки с самцом (Ерофеева, 2010; Павлова 2010), для чего в период гона каждого самца ссаживали с одной самкой на 1 ч. В отсутствие спариваний животных рассаживали. На следующий день ссаживания повторяли, подсаживая к самкам одних и тех же самцов. Если животные спаривались в течение 1 ч наблюдений, то их оставляли вместе еще на 3 ч, продолжая вести наблюдения. Более подробно методика ссаживания была описана ранее (Ерофеева, 2010). Ссаживания всегда проводили на территории самки. Для анализа поведения в данном исследовании мы включали только четырехчасовые ссаживания в период эструса самок (и их спариваний с самцом).
Дополнительным критерием наступления эструса у самок служили изменения частоты маркировочного поведения и частоты вокализации самки (Ерофеева, 2010; Ерофеева и др., 2015, 2017). Наблюдения проводили визуально с использованием метода непрерывной регистрации данных (Martin, Bateson, 2007; Алексеева и др., 2014). Для изучения дальневосточного кота и домашней кошки наряду с визуальными наблюдениями проводили видеосъемку поведения животных на цифровую видеокамеру Canon LEGRIA (Canon, Япония). Видеосъемку использовали в тех случаях, когда одновременно несколько самок приходили в эструс и исследователь физически не мог одновременно наблюдать за несколькими парами. Видеокамеру устанавливали таким образом, чтобы охватить всю вольеру, в которой проводилось ссаживание, и съемку вели с момента ссаживания до момента рассадки животных.

Дальневосточный лесной кот Prionailurus bengalensis
В дальнейшем видеоматериал обрабатывался с использованием метода непрерывной регистрации данных. При этом основное внимание уделялось общему числу актов взаимодействий между самкой и самцом, частоте и соотношению агрессивных и дружелюбных взаимодействий, оценивались частота спариваний и прекопуляторное поведение. Во всех взаимодействиях животных выделяли инициатора взаимодействий.
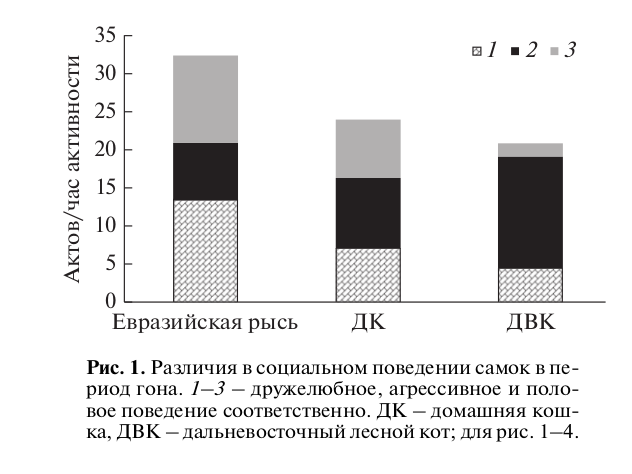
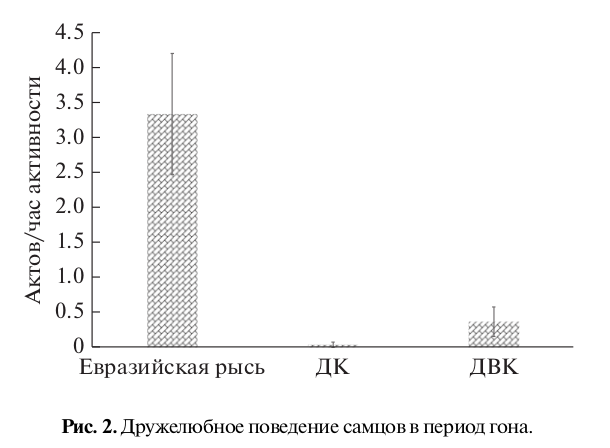
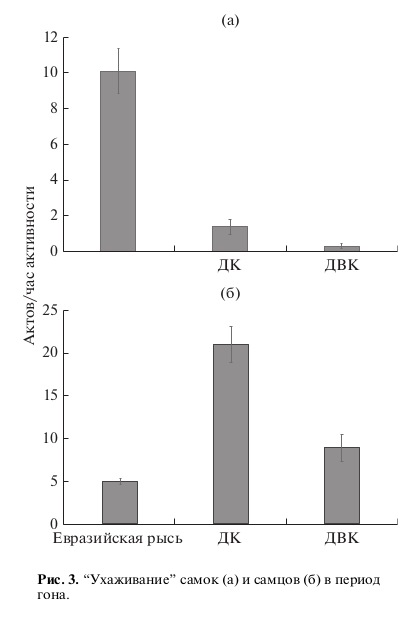
Рис. 1. Различия в социальном поведении самок в период гона. 1–3 – дружелюбное, агрессивное и половое поведение соответственно. ДК – домашняя кошка, ДВК – дальневосточный лесной кот; для рис. 1–4.
Агрессивное поведение включало в себя рык и шипение (Рутовская, Найденко, 2006), замах, выпад, удар лапой, драку. Дружелюбное поведение объединяло такие элементы поведения, как дружелюбная вокализация, социальная игра (погоня, борьба, приглашение на игру), аллогруминг и бодание (для рыси). Выделяли также “ухаживание”. У самок к элементам ухаживания мы относили все поведение, направленное на привлечение партнера и приводящее к дальнейшему спариванию (следование за самцом и подставление самцу анально-генитальной области, принятие позы лордоза, “потирание о партнера” и перемещение “плечом к плечу” (самка и самец прижимаются друг к другу боками и движутся по вольере, все поведение при этом сопровождается дружелюбной вокализацией).
В отличие от самок у самцов элементы “ухаживания” скорее были направленны не на привлечение партнера (как, например, дружелюбное потирание о партнера у самок евразийской рыси), а на принуждение к спариванию (преследование самки, попытки захвата, попытки спариться и т.д.) (Ерофеева, 2010; Ерофеева и др., 2017).
Всего было проанализировано поведение самцов и самок в 111 ссаживаниях евразийской рыси, 76 ссаживаниях дальневосточного кота и 42 ссаживаниях домашней кошки. Для статистического анализа использовали программы Microsoft Excel и Statistica 6.0. Данные на графиках представлены в виде средних значений и стандартной ошибки среднего (M ± SE). Для сравнительного анализа поведения кошачьих в период гона использовали критерий Краскел–Уоллисa (Kruskal–Wallis test).
Результаты исследования
Сравнительный анализ полученных нами данных выявил связь между поведением кошачьих в репродуктивный период и степенью выраженности полового диморфизма размера тела.
Социальное поведение самок разных видов кошачьих по отношению к самцам в период гона существенно различалось (рис. 1). Для самок евразийской рыси была характерна более высокая доля дружелюбного и полового поведения по отношению к самцу (>75% всех форм социальных взаимодействий), тогда как для самок дальневосточного кота отмечали высокую частоту агрессивного поведения (54% всех форм социальных взаимодействий). У самок домашней кошки не было отмечено существенной асимметрии в проявлении этих форм поведения по отношению к самцу: доли агрессивного, дружелюбного и полового поведения составляли 40, 30 и 30% соответственно.
Частоты проявления дружелюбного поведения самок по отношению к самцам в период гона достоверно различались у исследуемых видов (Kruskal–Wallis test: H = 10.17, p < 0.01). Самки евразийской рыси чаще демонстрировали дружелюбное поведение по отношению к самцу (13.34 ± 1.6 акт./ч активности), чем самки других видов. При этом дружелюбное поведение самок евразийской рыси выражалось не только в дружелюбной вокализации (как у двух других видов), они часто инициировали дружелюбные контакты с самцом – бодание, аллогруминг, игровые взаимодействия.
Такое поведение самок сопровождалось высокой частотой дружелюбных контактов со стороны самцов (рис. 2). У самцов евразийской рыси, как и у самок, мы отмечали достоверно большее число дружелюбных актов в отличие от такового у самцов других видов (H = 15.11, p < 0.001). При этом самцы домашней кошки дружелюбное поведение демонстрировали в единичных случаях, самцы дальневосточного лесного кота – чуть чаще.
Высокую частоту полового поведения мы наблюдали у самок евразийской рыси и домашней кошки (H = 19.69, p < 0.001). Однако если у самок домашней кошки большая доля полового поведения приходилась на спаривания, то у самок евразийской рыси >80% полового поведения приходилось на элементы “ухаживания”.
Самки евразийской рыси достоверно чаще демонстрировали элементы “ухаживания” по отношению к самцам в отличие от самок других видов (H = 23.67, p < 0.001) (рис. 3а). У самцов же наблюдалась иная картина (рис. 3б). Более высокая частота “ухаживания” отмечалась у самцов дальневосточного кота и домашней кошки. У самцов евразийской рыси мы отмечали самую низкую частоту “ухаживания” по отношению к самкам – в 3 раза ниже, чем у домашней кошки, и в 2 раза ниже, чем у дальневосточного кота (H = 14.47, p < 0.001).
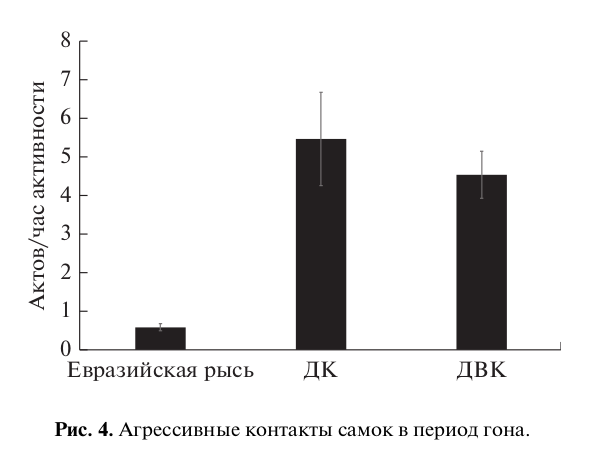
Такая настойчивость самцов в попытках спариться приводила к высокой частоте агрессивного поведения самок по отношению к самцам (рис. 4). При этом отмечался достоверно более высокий уровень контактной агрессии у самок домашней кошки и дальневосточного кота, чем у самок евразийской рыси (H = 17.82, p < 0.001). Однако агрессивные контакты со стороны самок не носили очень жесткого характера (укусы, драки) и ограничивались в основном ударом лапы и выпадом в сторону самца. Для них было более характерно избегать контакта с настойчивым партнером. Поскольку перемещение животных ограничено территорией вольеры, что естественно ограничивало возможности самки избежать контактов с самцом, практически единственный способ избежать нежелательного спаривания с самцом – спрятаться в убежище (домике).
У млекопитающих выращиванием потомства занимаются самки, вклад самцов, как правило, минимален [есть множество исключений, когда вклад самца сравним с самочьим или больше, в т.ч. среди хищных. Прим.публикатора]. Это создает предпосылки для различий в репродуктивных стратегиях животных разных полов: самцу выгодно максимизировать число партнерш, а самке – выбирать партнера с наилучшими генами (Birkhead, 2000). Среди млекопитающих промискуитет – наиболее распространенная система спариваний, описанная в том числе для 100% видов кошачьих (Lariviere, Ferguson, 2003). Конкуренция самцов в период гона у кошачьих может быть очень высока. Самцы могут быть очень настойчивы в поисках репродуктивно активной самки и в попытках спариться с ней (Breitenmoser et al., 1993; Найденко, Хупе, 2002), за самкой в период гона может следовать несколько самцов (Яблонский, 1905; Dards, 1983; Желтухин, 2003). В таких ситуациях для самца может быть выгодно заставить самку спариваться с ним как можно быстрее (Clutton-Brock, Parker, 1995).
Присутствие другого конспецифика своего пола может приводить к увеличению половой активности со стороны самца (delBarco-Trillo, Ferkin, 2004; Ерофеева, Найденко, 2011). По-видимому, интенсивность конкуренции самцов за самок существенно возрастает при увеличении плотности популяции животных. У домашних кошек в городах плотность популяций крайне высока – 2–3 тыс. особей на 1 км2 (Liberg, Sandell, 1988; Yamane, 1998; Say et al., 1999). В период гона с самкой может спариваться до девяти самцов (Izawa et al., 1982). В этом случае размер самцов может играть определяющую роль в их репродуктивном успехе. Показано, что более крупные самцы чаще спариваются с самками и имеют более высокий репродуктивный успех по сравнению с конспецификами (Yamane, 1998; Pörschmann et al., 2010). Однако успех этих самцов вряд ли связан с предпочтением самками более крупных самцов, скорее, самкам сложно избежать настойчивых “ухаживаний” более крупных самцов (Ерофеева и др., 2017).
Такая настойчивость в попытках спариться с самкой описана для многих видов животных с сильно выраженным половым диморфизмом размеров тела (Alcock et al., 1977; McKinney et al., 1983; Rubenstein, 1986; Le Boeuf, Mesnick, 1991; Clutton-Brock, Parker, 1995). Самцы принуждают самок к спариванию, поскольку их физические кондиции позволяют сделать это и подобные спаривания могут увеличить их репродуктивный успех (Clutton-Brock, Parker, 1995). У млекопитающих самцы обычно крупнее, а у хищных еще и “хорошо вооружены”. При этом разница размеров самцов и самок играет существенную роль в определении поведения животных. У северных морских слонов Mirounga angustirostris, например, самцы могут быть в 8 раз тяжелее самок и самки рискуют быть раздавленными самцом (Le Boeuf, Mesnick, 1991; Mesnick, Le Boeuf, 1991). У каланов Enhydra lutris самцы удерживают партнерш за нос своими зубами или когтями, часто ранят их и иногда могут утопить в процессе спаривания (Mestel, 1994) [этот стиль поведения калан сохраняет и когда спаривается не с тем объектом. Прим.публикатора].
Кошачьи, как и любой хищник, хорошо “вооружены” клыками и когтями, и даже небольшая драка при встрече самки с более крупным самцом может закончиться для нее серьезной травмой. При спаривании же самец удерживает самку зубами за холку и, в случае если самка пытается сопротивляться, может ранить ее (личные наблюдения). Настойчивость самца в “ухаживании” очень часто сопровождается вынужденным спариванием самки с партнером. Это вынужденное поведение – результат сексуального принуждения (“sexual coercion”) – явления, широко распространенного среди животных (Alcock et al., 1977; Clutton-Brock, Parker, 1995; Thonhauser et al., 2013) [в т.ч. у обыкновенного шимпанзе, но не бонобо. Прим.публикатора].
Выделяют три основные формы сексуального принуждения: принудительное спаривание, когда самец использует превышающую скорость или силу, чтобы ловить и физически удерживать самку; преследования, когда неоднократные попытки со стороны самца спариться с самкой побуждают ее к спариванию; запугивание, когда самцы наказывают самок, которые не хотят спариваться с ними, тем самым повышая шансы, что они будут принимать их в качестве партнеров на каком-то этапе в будущем (Clutton-Brock, Parker, 1995).
При этом все формы сексуального принуждения существенно влияют на поведение самок, так как активность самцов может приводить к серьезным травмам и даже к смерти самок или влиять на успех размножения самки в будущем. Так, некоторые самки морских слонов, которые оставляют (сравнительную) безопасность гаремов доминирующих быков, могут быть убиты нетерриториальными самцами (Mesnick, Le Boeuf, 1991). У ряда видов приматов самки спариваются с доминирующим самцом для снижения риска инфантицида в будущем (Hrdy, 1979; Smuts, 1986; Small, 1989).
Для домашней кошки спаривание с самцом для снижения риска инфантицида также очень актуально, особенно в условиях высокой плотности популяции (Macdonald et al., 1987; Natoli, 1990; Feldman, 1993), как и для многих других видов млекопитающих (Wolff, Macdonald, 2004; Klemme, Ylönen, 2010; Huchard et al., 2012).
В семействе кошачьих в период гона самцы демонстрируют преследование самок и принуждение к спариванию, у некоторых видов оно может заканчиваться гибелью самки (Brown et al., 1995). Самцы исследуемых нами видов кошачьих с сильно выраженным половым диморфизмом были очень настойчивы при “ухаживании” за самкой в период гона. При этом элементы “ухаживания” были направлены не на привлечение партнера, а на принуждение к спариванию. Самцы активно следовали за самкой, постоянно предпринимая попытки схватить самку за холку и спариться с ней. Однако такая настойчивость практически никогда не приводила к серьезным травмам и тем более к смерти самок (нами не было зафиксировано ни одной серьезной травмы у животных в ходе экспериментальных ссаживаний).
Вместе с тем для самок риск получить травму при активном “ухаживании” самца тем выше, чем крупнее (в относительном исчислении) самец [т. е., чем интенсивнее конкуренция самцов и выше развитость полового диморфизма, тем больше самцы «вкладываются» в агонистические взаимодействия друг с другом и меньше — в привлечение самок. Поэтому победивший самец самок принуждает силой. Прим.публикатора]. У евразийской рыси, вида со слабо выраженным половым диморфизмом, у которой размеры самцов и самок практически одинаковы, мы наблюдали противоположную картину. Как правило, инициатором спаривания была самка, по крайней мере она была очень настойчива в “ухаживаниях” по отношению к самцу. Самки активно следовали за самцом, подставляли самцу анально-генитальную область и проявляли по отношению к самцу высокую частоту дружелюбного поведения.
Вместе с тем подобные ухаживания самок никогда не были связаны с агрессивным поведением в случае отказа партнера от спаривания, что в корне отличалось от поведения самцов при отказе самок от спаривания. Высокую долю дружелюбного поведения и низкую долю агрессивного поведения самок евразийской рыси отмечали и ранее (Найденко, 1997), и эта особенность сильно отличает этот вид от многих других кошачьих. У большинства кошачьих обнаружено мало социальных, в том числе и дружелюбных, взаимодействий самок с самцами в период гона.
Это отмечено и нами для дальневосточного кота и домашней кошки, и Дж. Меллен (Mellen, 1993) для целого ряда других мелких видов кошек. У льва, самого, пожалуй, изученного из всех диких кошачьих, не было отмечено увеличения частоты каких-либо дружелюбных контактов и ухаживания у самцов и самок (Caro, 1994) (отношение масс тела самца и самки – 1.4 (Nowell, Jackson, 1996)). Для них характерно лишь увеличение частоты следования самцов за самками в эструсе (Caro, 1994), что отмечалось и для домашней кошки (Leyhausen, 1979).
Если самка не может избежать “ухаживаний” самца, она принимает его для спаривания, чтобы избежать травм при слишком интенсивном ухаживании (Clutton-Brock, Parker, 1995; Birkhead, 2000). При этом такое принудительное спаривание самцов с самками, вероятно, можно рассматривать как одну из форм полового отбора на уровне внутриполовой конкуренции (Smuts, Smuts, 1993), и оно может иметь важные последствия для эволюции морфологических признаков (Parker, 1979, 1983). Отбор самок, способных избегать притеснения со стороны самцов и выбирать партнера, может способствовать увеличению размера самок и снижению степени полового диморфизма в размерах. Считается, что это может быть одним из объяснений эволюции мономорфизма у некоторых полигинных приматов (Smuts, Smuts, 1993).
Кроме того, в ответ на очень настойчивое поведение самцов у самок могут развиваться поведенческие адаптации, которые позволяют снизить угрозу травм со стороны самцов. Например, самки морских слонов, покидающие гаремы, легко соглашаются на попытки спаривания со стороны периферических самцов и, вероятно, таким образом снижают риск травмирования (Mesnick, Le Boeuf, 1991). При этом для многих видов животных с территориальными самцами гарантией безопасности самок является присоединение к таким самцам (Clutton-Brock et al., 1992). У многих копытных самки в гаремах территориальных самцов реже подвергаются преследованиям, чем в гаремах нетерриториальных самцов, и демонстрируют более высокий успех размножения (Rubenstein, 1986; Clutton-Brock et al., 1993).
Однако такие поведенческие адаптации актуальны для полигинных и моногамных видов животных. Для большинства же кошачьих характерен одиночный образ жизни, самцы не могут монополизировать спаривания с самкой из-за особенностей пространственной организации этих животных (Lariviere, Ferguson, 2003; Ерофеева, Найденко, 2011). Самки, в свою очередь, не всегда могут повлиять на поведение самца, по крайней мере в нашем исследовании только самки евразийской рыси могли определять характер взаимоотношений с партнером. Вероятно, меньшая степень выраженности полового диморфизма при социальных контактах партнеров в период гона может обусловливать более ровные отношения партнеров в этот период. Мы можем предположить, что это также может обеспечивать большую избирательность самок, что ведет к снижению частоты спариваний с несколькими партнерами, а также к вероятности множественного отцовства в выводке, тогда как самки у видов с высокой степенью полового диморфизма вынуждены спариваться с большим числом самцов. Однако эта гипотеза нуждается в проверке в экспериментальных условиях.
Необходимо отметить, что условия проведения нашего эксперимента достаточно существенно отличалась от природных условий, например, ограниченностью территории, что позволяло самке уйти от контактов с самцом, только укрывшись в домике. Можно предположить, что в природе в подобной ситуации самка будет убегать от самца, однако, учитывая настойчивость последних, этa попытка вряд ли будет успешной. Другое отличие, особенно важное для домашней кошки, – контакты самок в период гона только с одним самцом. В природе самок кошачьих может преследовать несколько самцов, а у домашних кошек самки могут спариваться с девятью различными котами (Izawa et al., 1982). Соответственно, и отношения самок к самцам могут определяться “настойчивостью” не только отдельного самца, но и в целом группы потенциальных партнеров.
Мы исходили из предположения, что риск самки получить травму при агрессивном взаимодействии с самцом тем выше, чем больше разница в массе тела животных. Вместе с тем можно предположить, что самка при контакте с более крупными самцами может вести себя менее агрессивно, также снижая риск травмы. Однако наши данные не подтверждают этого предположения: самки домашней кошки и дальневосточного лесного кота, видов с высокой степенью выраженности полового диморфизма, были более агрессивны по отношению к самцам, чем самки евразийской рыси. Интересно проверить эту гипотезу на внутривидовом уровне, однако это – задача будущих исследований.
Авторы выражают благодарность Г. Алексеевой и А. Крыловичу за помощь в содержании коллекции животных и сборе материала. Экспериментальная работа с рысями и дальневосточными лесными котами выполнена при финансовой поддержке РФФИ (грант 15-04-07845 А), экспериментальные работы с домашней кошкой и обработка материалов выполнены при финансовой поддержке РНФ (18-14-00200).
Список литературы
Алексеева Г.С., Антоневич А.Л., Ерофеева М.Н., Найденко С.В. Социальная игра в онтогенезе внутривыводковых отношений евразийской рыси (Lynx lynx) // Изв. РАН. Сер. биол. 2014. No 4. С. 382–390.
Гептнер В.Г., Слудский А.А. Млекопитающие СССР. Хищные. Т. 2. Гиены и кошки. М.: Высш. шк., 1972. 551 с.
Давыдов В.Г. Социальная организация рыси на Южном Урале // Поведение животных в сообществах: Матер. III Всесоюз. конф. по поведению животных. М.: Наука, 1983. С. 117–119.
Ерофеева М.Н. Этолого-физиологические аспекты размножения евразийской рыси (Lynx lynx): Дис. канд. биол. наук. М.: ИПЭЭ РАН, 2010. 119 с.
Ерофеева М.Н., Найденко С.В. Пространственная организация популяций кошачьих и особенности их репродуктивных стратегий // Журн. общ. биологии. 2011. Т. 72. No 4. С. 284–297.
Ерофеева М.Н., Павлова Е.В., Найденко С.В. Влияние полового диморфизма в размере тела на репродуктивное поведение самок кошачьих: Матер. чтений и науч. конф., посвященных памяти профессора А.Г. Банникова и 100-летию со дня его рождения. М.: С/х-технологии, 2015. С.161–167.
Ерофеева М.Н., Алексеева Г.С., Сорокин П.А., Найденко С.В. Влияние количества партнеров и качества спермы на репродуктивный успех домашней кошки (Felis сatus) // Зоол. журн. 2017. Т. 96. No 10. С. 1243–1253.
Желтухин А.С. Центр Русской равнины. Рысь / Под ред. Матюшкина Е.Н., Вайсфельда М.М. М.: Наука, 2003. С. 137–165.
Котов В.А., Рябов Л.С. Промысловые и ценные млекопитающие подгорных и горных районов Краснодарского края // Тр. Кавказ. гос. Заповедника. Майкоп, 1963. Т. 7. С. 3–238.
Найденко С.В. Социальное поведение рыси (Lynx lynx Linnaeus, 1758) и особенности его формирования в онтогенезе: Автореф. дис. канд. биол. наук. М.: ИПЭЭ РАН, 1997. 24 с.
Найденко С.В. Особенности размножения и постнатального развития евразийской рыси. М.: КМК, 2005. 112 с.
Найденко С.В., Ерофеева М.Н. Размножение евразийской рыси и особенности репродуктивной стратегии самок // Зоол. журн. 2004. Т. 83. No 2. С. 261–269.
Найденко С.В., Хупе К. Сезонные изменения в использовании участков обитания одичавших домашних кошек (Felis silvestris var. catus) в Золлинге, Центральная Германия // Зоол. журн. 2002. Т. 81. No 11. С. 1371–1381.
Павлова Е.В. Взаимосвязь социального поведения и гормонального статуса у дальневосточного лесного кота (Prionailurus bengalensis euptilura): Автореф. дис. канд. биол. наук. М.: ИПЭЭ РАН, 2010. 24 с.
Пикунов Д.Г., Коркишко В.Г. Леопард Дальнего Востока. М.: Наука, 1992. 192 с.
Рутовская М.В., Найденко С.В. Звуковая сигнализация евразийской рыси (Lynx lynx, Felidae) // Бюл. МОИП, отд. биол. 2006. Т. 111. No 1. С. 3–9.
Юдаков А.Г., Николаев И.Г. Экология амурского тигра. М.: Наука, 1987. 153 с.
Яблонский Н.И. Рыси и охота на них // Природа и охота. Август. 1905. С. 31–40.
Alcock J., Eickwort G.C., Eickwort K.R. The reproductive behavior of Anthidium maculosum (Hymenoptera: Megachilidae) and the evolutionary significance of multiple copulations by females // Behav. Ecol. Sociobiol. 1977. V. 2. No 4. P. 385–396.
Allaine D., Graziani L., Coulon J. Postweaning mass gain in juvenile alpine marmots Marmota marmota // Oecologia. 1998. V. 113. P. 370–376.
Andersson M. Sexual selection. Princeton: Princeton Univ. Press, 1994. 624 p.
Birkhead T. Promiscuity: an evolutionary history of sperm competition and sexual conflict. L.: Faber and Faber, 2000. 272 p.
Boonstra R., Xia X., Pavone L. Mating system of the meadow vole, Microtus pennsylvanicus // Behav. Ecol. 1993. V. 4. P. 83–89.
Breitenmoser U., Kaszensky P., Dotterer M., Wursten Ch., Capt S., Bernhart F., Liberek M. Spatial organization and recruitment of lynx (Lynx lynx) in a re-introduced population in the Swiss Jura Mountains // J. Zool. Lond. 1993. V. 231. No 3. P. 449–464.
Brown J.L., Wildt D.E., Graham L.H., Byers A.P., Collins L., Barrett S., Howard J.G. Natural versus chorionic gonadrotropin-induced ovarian responses in the clouded leopard (Neofelis nebulosa) assessed by fecal steroid analysis // Biol. Reprod. 1995. V. 53. P. 93–102.
Caro T.M. Cheetahs of the Serengeti Plains: group living in an asocial species. Chicago: Univ. Chicago Press, 1994. 500 p.
Clutton-Brock T.H., Parker G.A. Sexual coercion in animal societies // Anim. Behav. 1995. V. 49. No 5. P. 1345–1365.
Clutton-Brock T.H., Deutsch J.C., Nefdt R.J.C. The evolution of ungulate leks // Anim. Behav. 1993. V. 46. P. 1121–1138.
Clutton-Brock T.H., Price O., MacColl A. Mate retention, harassment and the evolution of ungulate leks // Behav. Ecol. 1992. V. 3. P. 234–242.
Coltman D.W., Bancroft D.R., Robertson A., Smith J.A., Clutton-Brock T.H., Pemberton J.M. Male reproductive success in a promiscuous mammal: behavioural estimates compared with genetic paternity // Mol. Ecol. 1999. V. 8. P. 1199–1209.
Dards J.L. The behavior of dockyard cats: interactions of adult males // Appl. Anim. Ethol. 1983. V. 10. P. 133-153.
delBarco-Trillo J., Ferkin M.H. Male mammals respond to a risk of sperm competition conveyed by odours of conspecific males // Nature. 2004. V. 431. P. 446–449.
Feldman H.N. Maternal care and differences in the use of nests in the domestic cat // Anim. Behav. 1993. V. 45. No 1. P. 13–23.
Grassman L.I., Tewes M.E., Silvy N.J., Kreetivutanont K. Spatial organization and diet of the leopard cat (Prionailurus bengalensis) in north-central Thailand // J. Zool., Lond. 2005. V. 266. No 1. P. 45–54.
Hornocker M.G. Winter teritoriality in mountain lions // J. Wildl.Manag. 1969. V. 33. No 3. P. 457–464.
Hrdy S.B. Infanticide among animals: a review, classification, and examination of the implications for the reproductive strategies of females // Ethol. Sociobiol. 1979. V. 1. P. 13–40.
Huchard E., Canale C.I., Le Gros C., Perret M., Henry P.Y., Kappeler P.M. Convenience polyandry or convenience polygyny? Costly sex under female control in a promiscuous primate // Proc. Biol. Sci. The Royal Soc. 2012. V. 279. No 1732. P. 1371–1379.
Isaac J.L. Potential causes and life-history consequences of sexual size dimorphism in mammals // Mamm. Soc. Mamm. Rev. 2005. V. 35. No 1. P. 101–115.
Isaac J.L., Johnson C.N. Sexual dimorphism and synchrony of breeding: variation in polygyny potential among populations in the common brushtail possum, Trichosurus Vulpecula // Behav. Ecol. 2003. V. 14. P. 818–822.
Izawa M., Doi T., Ono Y. Grouping patterns of feral cats (Felis catus) living on a small island in Japan // Jap. J. Ecol. 1982. V. 32. P. 373–382.
Jedrzejewski W., Jedrzejewska B., Okarma H., Schmidt K., Bunevich A.N, Milkowski L. Population dynamics (1869-1994), demography, and home ranges of the lynx in Bialowieza Primeval Forest (Poland and Belarus) // Ecography. 1996. V. 19. No 1. P. 122–138.
Johannesen E., Andreassen H.P., Ims R.A. The effect of patch isolation on reproductive synchrony in the root vole // Oikos. 2000. V. 89. P. 37–40.
Jones E., Coman B.J. Ecology of the feral cat, Felis catus (L.), in South-Eastern Australia. II. Home ranges and population ecology in semiarid North-West Victoria // Aust. Wildl. Res. 1982. V. 9. P. 409–420.
Kappeler P.M., Fichtel C. Eco-evo-devo of the lemur syndrome: did adaptive behavioral plasticity get canalized in a large primate radiation? // Front. Zool. 2015. V. 12. P. 15.
King W.J., Allainé D. Social, maternal, and environmental influences on reproductive success in female Alpine marmots (Marmota marmota) // Can. J. Zool. 2002. V. 80. P. 2137–2143.
Klemme I., Ylönen H. Polyandry enhances offspring survival in an infanticidal species // Biol. Lett. 2010. V. 6. No 1. P. 24–26.
Lariviere S., Ferguson S.H. Evolution of induced ovulation in North American carnivores // J. Mamm. 2003. V. 84. No 3. P. 937–947.
LeBlanc M., Festa-Bianchet M., Jorgenson J.T. Sexual size dimorphism in bighorn sheep (Ovis canadensis): effects of population density // Can. J. Zool. 2001. V. 79. P. 1661–1670.
Le Boeuf B.J., Mesnick S.L. Sexual behavior of male northern elephant seals: I. Lethal injuries to adult males // Behaviour. 1991. V. 116. P. 143–162.
Leyhausen P. Cat behavior: The predatory and social behavior of domestic and wild cats. N.Y.: Garland STPM Press, 1979. 340 p.
Liberg O. Predation and social behaviour in a population of domestic cats: an evolutionary perspectives: PhD thesis. Lund, Sweden: Univ. Lund, 1981. 135 p.
Liberg O., Sandell M. Spatial organisation and reproductive tactics in the domestic cat and other felids // The Domestic Cat: the Biology of its Behaviour / Eds Turner D.C., Bateson P. Cambridge: Cambr. Univ. Press, 1988. P. 83–98.
Lindenfors P., Nunn C.L., Barton R.A. Primate brain architecture and selection in relation to sex // BMC Biol. 2007. V. 5. P. 20.
Loison A., Gaillard J.M., Pélabon C., Yoccoz N.G. What factors shape sexual size dimorphism in ungulates? // Evol. Ecol. Res. 1999. V. 1. P. 611–633.
Macdonald D.W., Apps P.J., Carr G.M., Kerby G. Social dynamics, nursing coalitions and infanticide among farm cats, Felis catus // Adv. Ethol. 1987. V. 28. P. 1–64.
Martin P., Bateson P. Measuring behaviour: an introductory guide. N.Y.: Cambr. Univ. Press, 2007. 188 p. McKinney F., Derrickson S.R., Mineau P. Forced copulation in waterfowl // Behaviour. 1983. V. 86. P. 250–294.
Mellen J.D. A comparative analysis of scent-marking, social and reproductive behavior in 20 species of small cats (Felis) // Amer. Zool. 1993. V. 33. P. 151–166.
Mesnick S.L., Le Boeuf B.C. Sexual behavior of male northern elephant seals II. Female response to potentially injurious encounters // Behaviour. 1991. V. 117. P. 262–280.
Mestel R. Seamy side of sea otter life // New Sci. 1994. V. 1913. P. 5–6.
Natoli E. Mating strategies in cat: a comparison of the role and importance of infanticide in domestic cat Felis catus L., and Lions Panthera leo L. // Anim. Behav. 1990. V. 40. P. 183–186.
Nowell K., Jackson P. Wild cats: status survey and conservation action plan. Gland, Switzerland: IUCN/SSC Cat Specialist Group, 1996. 383 p.
Parker G.A. Sexual selection and sexual conflict // Sexual Selection and Reproductive Competition / Eds Blum M.S., Blum N.A. N.Y.: Acad. Press, 1979. P. 123–166.
Parker G.A. Mate quality and mating decisions // Mate Choice / Eds Bateson P.P.G. Cambridge: Cambr. Univ. Press, 1983. P. 141–166.
Pontier D., Natoli E. Male reproductive success in the domestic cat (Felis catus L.): A case history // Behav. Proc. 1996. V. 37. P. 85–88.
Poole K.G. Characteristics of an unharvested lynx population during a snowshoe hare decline // J. Wildl. Manag. 1994. V. 58. No 4. P. 608–618.
Poole K.G. Spatial organization of a lynx population // Can. J. Zool. 1995. V. 73. No 4. P. 632–641.
Pörschmann U., Trillmich F., Mueller B., Wolf J.B.W. Male reproductive success and its behavioural correlates in a polygynous mammal, the Galápagos sea lion (Zalophus wollebaeki) // Mol. Ecol. 2010. V. 19. No 12. P. 2574–2586.
Rubenstein D.I. Ecology and sociality in horses and zebras // Ecological Aspects of Social Evolution / Eds Rubenstein D.I., Wrangham R.W. Princeton, New Jersey: Princeton Univ. Press, 1986. P. 282–302.
Say L., Pontier D., Natoli E. High variation in multiple paternity of domestic cat (Felis catus L.) in relation to environmental conditions // Proc. Roy. Soc. B: Biol. Sci. 1999. V. 266. P. 2071–2074.
Say L., Devillard S., Natoli E., Pontier D. The mating system of feral cats (Felis catus L.) in a sub-Antarctic environment // Polar Biol. 2002. V. 25. No 11. P. 838–842.
Schulte-Hostedde A.E., Millar J.S., Gibbs H.L. Sexual selection and mating patterns in a mammal with female-biased sexual size dimorphism // Behav. Ecol. 2004. V. 15. No 2. P. 351–356.
Schulte-Hostedde A.E., Millar J.S., Hickling G.J. Sexual dimorphism in body composition of small mammals // Can. J. Zool. 2001. V. 79. P. 1016–1020.
Seidensticker J.C., Jr., Hornocker M.G., Wiles W.V., Messick J.P. Mountain lion social organization in the Idaho Primitive Area // Wildl. Monogr. 1973. V. 35. 60 p.
Sliwa A. Home range size and social organisation of blackfooted cats (Felis nigripes) // Mamm. Biol. 2004. V. 69. No 2. P. 96–107.
Small M.F. Female choice in nonhuman primates // Amer. J. Phys. Anthropol. 1989. V. 32. P. 103–127.
Smuts B.B. Sexual competition and mate choice // Primate Societies / Eds Smuts B.B., Cheney D.L., Seyfarth R.M., Wrangham W.R., Struhsaker T.T. Chicago: Univ. Chicago Press, 1986. P. 385–399.
Smuts B.B., Smuts R.W. Male aggression and sexual coercion of females in nonhuman primates and other mammals: evidence and theoretical implications // Adv. Study Behav. 1993. V. 22. P. 1–63.
Storz J.F., Balasingh J., Bhat H.R., Nathan P.T., Doss D.P.S., Prakash A.A., Kunz T.H. Clinal variation in body size and sexual dimorphism in an Indian fruit bat, Cynopterus sphinx (Chiroptera: Pteropodidae) // Biol. J. Linn. Soc. 2001. V. 72. P. 17–31.
Thonhauser K.E., Raveh S., Hettyey A., Beissmann H., Penn D.J. Scent marking increases male reproductive success in wild house mice // Anim. Behav. 2013. V. 86. P. 1013–1021.
Trivers R. Parental investment and sexual selection // Biological Laboratories. Harvard Univ. 1972. V. 136. 179 p.
Wolff J.O., Macdonald D.W. Promiscuous females protect their offspring // Trends Ecol. Evol. 2004. V. 19. No 3. P. 127–34.
Yamane A. Male reproductive tactics and reproductive success of the group-living feral cat (Felis catus) // Behav. Proc. 1998. V. 43. No 3. P. 239–249.
Известия РАН. Серия биологическая. 2020. №1. С.58–66