Рис. 1. «Хотелось лечь, прикрыть бы телом…», — пел Леонид Утесов. На картинке видно, как божья коровка прикрывает телом вышедшую из нее личинку наездника. Яркая окраска отпугивает хищников, а для большего устрашения насекомое периодически подрагивает всем телом. Так продолжается примерно неделю, после чего наездник выходит из яйца и улетает, а божья коровка… Божья коровка даже иногда выживает, но это неважно, неважно. Источник изображения – Maure et al., 2011
Резюме. Публикуется обзор М.В.Гопко и В.Н.Михеева, посвящённый паразитическим манипуляциям — направленным изменениям паразитом морфологии и поведения хозяина, повышающим приспособленность первого, с интересными и новыми данными о паразитах как «клее» биотических отношений в экосистемах, с критическими замечаниями публикатора.
От публикатора: что не так с «парадигмой Панглосса» применительно к паразитическим манипуляциям?
Содержание
- 1 От публикатора: что не так с «парадигмой Панглосса» применительно к паразитическим манипуляциям?
- 2 ***
- 3 I. Паразитические манипуляции: терминология, история, теоретические предпосылки и перспективы
- 4 II. Основные стратегии манипулирования. “Классическая манипуляция” (манипуляция неинвазионных паразитов)
- 4.1 Манипуляции моноксенных паразитов
- 4.2 Манипуляции паразитоидов и гетероксенных паразитов
- 4.3 Toxoplasma gondii: один паразит — две стратегии манипуляции
- 4.4 Экспериментальные полевые исследования манипуляций
- 4.5 В какой момент паразит должен начать манипулировать своим хозяином? Специфичность манипуляции
- 5 III. “Неклассическая” манипуляция. Конфликты, кооперация и эусоциальность у паразитов
- 6 IV. Паразитические манипуляции и их роль в экосистеме
- 7 Заключение
Последние вызваны некритическим (сорри за тавтологию) следованиям идеям Р.Докинза и, шире, социобиологии, рассматривающей тела индивидов, реализующие «должное» поведение в «должных» моментах взаимодействия, как управляемые изнутри комбинациями «эгоистичных генов» (Alexander, 1974, 1975). Последние неизбежно додумываются, выступая в лучшем случае полезными фикциями; современные данные об организации генных сетей, их участия в «эволюции в пространстве возможностей» показывают что
а) гены — никак не «эгоистичные репликаторы» Р.Докинза, они иерархически организованы и управляемы «сверху», со стороны организма, как любые другие морфоструктуры;
б) именно организмы, не отдельные гены, оказываются единицей отбора на уровне популяции. Последний же совершенствует не индивидов с их качествами, выживанием или размножением (все эти параметры могут и ухудшаться, как падает размножаемость по мере прогресса социальности у грызунов), но разного рода приспособления вида, от морфологии до жизненных стратегий, в т.ч. описанные в статье паразитические манипуляции. Сюда же относятся регуляторы, выступающие «передаточным механизмом» в генных сетях, от сигналов об изменении внешней/внутренней среды, до компенсирующих ответов в виде изменений экспрессии генов, что в эволюционных масштабах времени меняет темп эволюции как самих генетических «текстов», так и «конструкции» генных сетей, «читающих» их для оптимального реагирования на изменения среды, как фабрики отвечают на изменения рыночной конъюнктуры. Сами индивиды, их перемещения и взаимодействия друг с другом ли, с биоценотическими ли партнёрами, оказываются лишь «статистическими испытаниями» и «расходным материалом» для вышеописанного (это т.н. социоцентрический — или популяционноцентрический взгляд на поведение);
в) вопреки всем заявлениям социобиологов, «эгоистичные репликаторы», «гены альтруизма/эгоизма», вообще «гены поведения» и т.д. мысленные конструкты до сих пор не связали с конкретными генными вариантами, и не особо пытаются. Поскольку картина реальной эволюции соотносится с социобиологическим описанием происходящего как грани куба Неккера (используя замечательную метафору из «Эгоистичного гена»). Если преобразования тел организмов, в т.ч. видоспецифических форм поведения, обслуживающих меняющиеся отношения особей в популяции, есть главное в эволюции, то изменения на уровне генов и/или физиологии, связанных с первыми и влияющих на них – их «тень» (эпифеномен) или, точнее «отдача» происходящей эволюции. Организация меняется в ответ на эти последние так, чтобы обеспечить устойчивость новшеств, поддерживаемых и усиливаемых отбором, и при этом не вымереть (поскольку и организм, и его генетические системы целостны).
И действительно, в настоящей статье много и интересно рассказывается о поведенческих и/или физиологических феноменов, связанных с манипуляцией хозяином, и реакцией последнего на эти воздействия и совсем ничего — о генах того и другого, «эгоистически» увеличивших своё реплицирование благодаря подобным приёмам. А ведь согласно идеологии автора, с этого надо б начать!
На деле сколько-нибудь подробный анализ показывает, что «гены», «эгоистичность» и «отбор на уровне генов» здесь — лишь риторические приёмы, дающие видимость объяснения. Неслучайно среди исследований паразитических манипуляций, фигурирующих в настоящем обзоре, во многих реконструированы проксимальные механизмы, обеспечивающие их эффективность и биоценотическую роль благодаря «ближайшим эффектам» поведенческих воздействий паразита и физиологических реакций на них хозяина, но нет ни одной реконструкции ультимаативных механизмов, выводящих наблюдаемые в природе манипуляции из вышеназванной «докинзовской триады».
«Эгоистичность» понимается как управление геном «подвластных» ему аспектов поведения организма, но не только его – также и биоценотических партнёров (Hamilton, 1963, 1964, 1971; Trivers, 1971, 1972, 1974). Это т.н. «длинная рука гена», одно из проявлений которой — обсуждаемые паразитические манипуляции. Последние, как и «управление» телами самих организмов, по мысли социобиологов, производится генами так, чтобы максимизировать их репликацию и передачу в нисходящем колене, даже когда это вредит выживанию (затрудняет существование) тел, самого ли животного, или его биоценотических партнёров.
Эволюция выступает здесь как «слепой часовщик». Она подбирает нужные организму паттерны среды и параметры стимуляции а) «кусок за куском», как бы собирая паззл, б) «вслепую», через попытки управлять ими, реализуя определённое поведение организмов, и отбор успешных попыток) так, чтобы «на финише» жизненного цикла особей, после реализации всего поведения, во всех видотипичных жизненных обстоятельствах, обеспечивать максимально расширенное воспроизводство копий данного репликатора (гена или генного варианта) в сравнении с конкурирующими вариантами (Wilson, 1975; Докинз, 1993, 2006).
По мысли социобиологов, «эгоизм» состоит в усилении и качественном «оттачивании» этого управления отбором на уровне генов (а не фенотипа), естественно, если «выигрыш» от манипуляции превзойдёт «плату». Это крупнейшее методическое достижение социобиологии — мысль, что эволюционное новшество в морфологии ли, в поведении ли, помимо выигрыша (benefit), следующего из адаптивности, всегда предполагает «плату» (cost) в виде 1) затрат вещества, времени и энергии на образование соответствующих форм и структур, 2) специфических рисков при «должном» предъявлении данных органов, например, брачных украшений и ритуализированных демонстраций, в «должной» ситуации взаимодействия, почему 3) Отбор формирует соответствующую манипуляцию — что коммуникативную, посредством эффектов видовых демонстраций (Dawkins, Krebs, 1978), что паразитические, анализируемые в данной статье, лишь в том случае, когда «выигрыш» от неё существенно превосходит «плату» (измеряемую в конечном счёте не в затратах энергии или пластических веществ, а в последствиях их совершения для итоговой приспособленности). В ситуации «за морем телушка полушка, да рупь перевоз» манипуляции не формируются, какие б не следовали выгоды от появления «у гена» такой «длинной руки».
Здесь проявляется ещё одно противоречие социобиологии — между методическими достижениями и дефектной теорией, толкающей к т.н. эффекту Панглосса, когда каждая хорошо выраженная особенность биологии вида представляется адаптацией, «для чего-то полезной» и «чем-то выгодной». Внутренние противоречия этого взгляда и следующие из него ошибки разобраны в знаменитой статье Ст.Дж.Гулда и Р.С.Левонтина про «Пазухи свода собора святого Марка и парадигму Панглосса» («Spandrels…, 1979), и я лишь добавлю ещё одно.
Он превращает науку в область счастливых догадок (как высказался А.Куприянов о «популяризации» этологии в известных книгах В.Р.Дольника, однако, увы, это в полной мере присуще и «настоящей науке»). Какой бы паттерн поведения ни остановил на себе взгляд исследователя, всё оказывается адаптивным, надо лишь догадаться почему (чтоб потом подобрать данные «под гипотезу»), хотя есть более чем убедительные основания считать, что все без исключения первые впечатления такого рода будут ошибочными — даже о структуре поведения (членение на единицы, их форма и пр.) , а уж тем более об их функции, см. «Уязвимость «парадигмы Панглосса-1, -2, -3″.. К тому же догадки высказываются от имени «современной (читай — единственно верной) эволюционной теории», толкая её авторитетом соответствующие объяснения всячески подкреплять и «спасать», когда плохо соответствуют фактам, вместо необходимого для учёного трезвого скепсиса в первую очередь к следствиям собственной концепции, теоретическим или проверенным в опыте, ведь без этого её не усовершенствуешь, здесь попперовский фальсификационизм рулит.
***
М.В.Гопко, В.Н.Михеев
Паразиты воздействуют на своих хозяев самыми различными способами. В тех случаях, когда они меняют фенотип своих хозяев с целью увеличить собственную приспособленность, говорят о манипуляциях паразитов фенотипом хозяина. Вероятно, не все паразиты манипулируют поведением своих хозяев, но, несомненно, паразитические манипуляции весьма распространенный природный феномен. Паразит может менять фенотип хозяина, чтобы обеспечить себе дополнительную защиту, создать оптимальные условия для роста и развития и, разумеется, чтобы успешно решить задачу переноса от одного хозяина к другому. Стратегии манипулирования необычайно многообразны и тесно связаны с жизненным циклом паразита. В обзоре мы даем представление об основных типах манипулятивных стратегий и обсуждаем, как та или иная стратегия могла сформироваться в ходе эволюции, почему одни стратегии встречаются чаще, чем другие, и как меняется стратегия манипулирования по ходу роста и развития паразита. Только недавно стали осознавать, что паразитические манипуляции — фактор, влияющий как на взаимоотношения в инфрасообществе паразитов внутри хозяина, так и на всю экосистему в целом. В двух последних разделах обзора мы рассказываем о конфликтах и кооперации между паразитами-манипуляторами, а также о роли паразитических манипуляций в экосистемах. Завершается обзор мысленным путешествием в недалекое будущее, в ходе которого мы коротко рассказываем о том, какой может стать роль паразитов и их манипуляций в этом изменяющемся на глазах мире.
Вниманию читателей предлагается обзор, посвященный манипуляциям паразитов. Под паразитическими манипуляциями понимают изменения фенотипа хозяина, вызванные паразитом и повышающие приспособленность последнего (Dawkins, 1999; Poulin, 2010). Мы старались охватить тему максимально широко, чтобы показать, как паразитические манипуляции могут быть связаны с другими актуальными темами современной биологии.
Нам кажется, что это отражает современные тенденции в этой отрасли знаний, поскольку стало очевидно, что паразитические манипуляции это не забавный эволюционный курьез, а широко распространенный феномен, имеющий большое значение в живой природе (Dawkins, 2004, Poulin, 2010; Moore, 2013; Hughes, 2014; Heil, 2016). Тем не менее, многие важные вопросы, например манипуляции паразитов, переносящихся половым путем (Heil, 2016), роль манипуляций в экосистемах и пр. до сих пор изучены очень мало (Poulin, 1999; Lefevre et al., 2009; Weinersmith, Faulkes, 2014).
Ситуация осложняется еще и тем, что большинство паразитов одновременно существуют в двух экосистемах: внутренней — в организме хозяина, где им приходится взаимодействовать с другими паразитами, и внешней, где обитает хозяин и свободноживущие стадии паразита (Poulin, 1999). Кроме того, стратегии манипулирования поведением хозяина, применяемые паразитами, необычайно многообразны, как и возможные взаимодействия между паразитами и экосистемами, в которых они обитают. В нашем обзоре мы пытались дать представление как о достаточно глубоко изученных темах, так и о самом переднем крае науки о паразитических манипуляциях. Новых интересных направлений в изучении манипуляций сейчас формируется великое множество, и мы не претендуем на то, что наш обзор окажется всеобъемлющим. Мы, скорее, пытались подробно описать направления, казавшиеся нам наиболее интересными и перспективными, обращая внимание в первую очередь на самые современные и цитируемые исследования. Хотя паразитические манипуляции представляют большой теоретический интерес для эволюционистов (теория даже немного опережает экспериментальные исследования (Poulin, Maure, 2015)), мы по мере возможности старались иллюстрировать каждое новое понятие или гипотезу примерами из экспериментальных исследований, не вдаваясь в излишние отвлеченности.
Обзор состоит из четырех частей. В первой мы обсуждаем некоторые терминологические тонкости, даем краткий очерк развития представлений о паразитических манипуляциях и подробно обсуждаем место манипуляций в современных представлениях об эволюции живых систем. Во второй части мы описываем основные типы манипуляций и делаем попытку их классифицировать. Эта классификация в достаточной степени условна, но мы надеемся, что она поможет читателю уложить в голове большое количество представленных нами фактических данных. В третьей части обзора мы рассказываем о манипуляциях неинвазионных паразитов и касаемся вопросов, связанных с обитанием паразита во внутренней экосистеме — организме хозяина: конфликтов и кооперации между паразитами, а также затрат на манипуляции. Наконец, в последнем разделе мы обсуждаем, какие воздействия может оказывать паразит на экосистему в целом.
I. Паразитические манипуляции: терминология, история, теоретические предпосылки и перспективы
Манипуляции паразитов фенотипом vs манипуляции поведением хозяина.
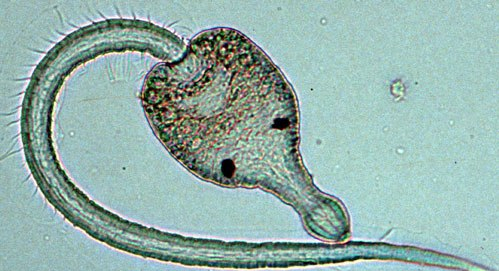
Одной из центральных задач паразитологии является изучение способов переноса паразитов или их потомства от одного хозяина к другому (Thomas et al., 2005). Среди большого количества возможных стратегий есть одна, которая вот уже на притяжении нескольких десятилетий привлекает интерес исследователей и вызывает оживленную дискуссию,— стратегия манипуляции паразита фенотипом своего хозяина. Традиционно принято говорить о манипуляциях паразита поведением хозяина, однако, строго говоря, манипуляции нередко затрагивают целый комплекс фенотипических черт хозяина как поведенческих, так и морфологических, и физиологических. Например, трематоды Leucochloridium spp. поселяются в глазных щупальцах улиток, окрашивая их в яркие цвета и заставляя пульсировать (Dawkins, 1999; Wesolowska, Wesolowski, 2013).

Янтарка обыкновенная, поражённая трематодой Leucochloridium paradoxum
Подобные изменения фенотипа улитки делают ее более заметной для следующего хозяина паразита — птицы. По всей видимости, птицы принимают ярко окрашенные щупальца улитки за гусениц или каких-то других личинок насекомых, склевывают их и в свою очередь заражаются трематодами, помогая паразиту завершить жизненный цикл (Dawkins, 1999: Пер. с англ. Докинз, 2010; Wesolowska, Wesolowski, 2013). Изменения во внешнем виде улитки сопровождаются изменениями в ее поведении: зараженные спороцистами Leucochloridium spp. улитки более активны, совершают длинные переходы, проводя много времени на открытых пространствах и поднимаются выше по стеблям растений по сравнению с незараженными улитками (Wesolowska, Wesolowski, 2013). Хотя в данном случае влияние паразита на своего хозяина не ограничивалось поведением, воздействие Leucochloridium spp. на фенотип улитки тоже принято называть паразитической манипуляцией (Wesolowska, Wesolowski, 2013).
То же относится, например, и к нематодам Myrmeconema neotropicum, паразитирующим в абдомене муравьев Cephalotes atratus (Yanoviak et al., 2008). Если незараженные муравьи полностью окрашены в черный цвет, то брюшко зараженных ярко-красное и приподнято вверх. В этом примере паразиты вновь сочетают манипуляцию поведением с манипуляцией внешним обликом хозяина. Вероятно, ярко окрашенное брюшко муравья привлекает птиц, принимающих его за ягоду, они съедают муравья и разносят яйца нематод со своими фекалиями (Yanoviak et al., 2008). Еще одним примером не поведенческих манипуляций паразита может служить феминизация самцов или индукция партеногенеза вольбахией (Volbachia spp.) (Werren et al., 2008) — бактерией, которая является облигатным паразитом яйцеклеток многих видов беспозвоночных (например, от 40 до 66% наземных членистоногих по современным оценкам заражены этим паразитом (Zug, Hammerstein, 2012).

Муравей Cephalotes atratus, заражённый нематодой Myrmeconema neotropicum, поднимает покрасневшее брюшко.
Развитие представлений о манипуляциях паразитов фенотипом хозяина.
Первые предположения о том, что паразиты способны менять фенотип своего хозяина с целью увеличить собственную приспособленность появились еще в середине XX столетия. Например, Доббен (Dobben, 1952) обратил внимание на тот факт, что рыбы, зараженные цестодой Ligula intestinalis, значительно чаще становятся жертвой рыбоядных птиц — окончательных хозяев этого паразита. Однако первыми, кто начал рассматривать изменения поведения хозяина с точки зрения адаптации паразита, были канадские исследователи Бетл и Холмс, выпустившие в середине 1970-х годов серию статей, посвященных этому вопросу (Bethel, Holmes, 1973, 1974, 1977). Они изучали поведение амфипод (Gammarus lacustris и Hyalella azteca), зараженных скребнями (несколько видов), окончательные хозяева которых — водоплавающие птицы. Незараженные рачки — фотофобы, при малейшей угрозе ныряющие на глубину. Однако амфиподы, зараженные цистакантами скребней, ведут себя иначе. Во-первых, в отличие от незараженных рачков, они фотофильны и стремятся к свету. Во-вторых, почувствовав опасность, они не ныряют а, напротив, скользят в верхних слоях воды и/или прикрепляются к мелкому мусору на поверхности водоема (Bethel, Holmes, 1973, 1974). Более того, поведение рачков менялось именно тогда, когда паразиты достигали инвазионной стадии, т.е. были готовы заразить следующего хозяина (Bethel, Holmes, 1974). Наконец, Бетлу и Холмсу удалось показать, что эти поведенческие изменения действительно увеличивают вероятность попадания амфипод в пищеварительный тракт водоплавающей птицы (Bethel, Holmes, 1977). Все эти данные позволили этим ученым высказать предположение, что паразит в их экспериментах целенаправленно менял поведение своего хозяина с целью увеличить собственную приспособленность. Подобный подход привлек внимание широкого круга исследователей-экспериментаторов, и к настоящему моменту число примеров паразитических манипуляций уже исчисляется сотнями (Poulin, 2010).
Опыты В. Бетла и Дж. Холмса могли бы остаться незамеченными, не совпади они по времени с глобальной сменой парадигмы в биологии. В 70-е годы XX века взгляд биологов на организм, как таковой, претерпел существенные изменения. Во-первых, биологи обратили внимание, что естественный отбор, на самом деле, действует не на организменном уровне, а на уровне генов (Dawkins, 1976: Пер. с англ. Докинз, 1993). Организм же представляет для генов всего лишь удобную среду обитания или, как метафорически выразился известный эволюционист Р. Докинз,— “машину выживания”. Во-вторых, на поведение животных (как, впрочем, и на их фенотип в целом) оказывают влияние самые различные гены, зачастую находящиеся в разных организмах (Докинз, 2010). Простейший пример, пение самца канарейки заставляет клетки гипофиза самки производить больше гонадотропинов. Другими словами, гены самца, ответственные за пение, “коварно вмешиваются” в работу гипофиза самки, чтобы подготовить ее к спариванию (Докинз, 2010, с. 117— 118). В-третьих, интересы генов нередко расходятся, и тогда фенотип особи является некоторым “компромиссом” между двумя крайностями (выгодой только для одной или только для другой группы генов)(Докинз, 2010, гл. 8,13). Эти соображения легли в основу концепции “расширенного фенотипа”, которую можно кратко сформулировать так:
“поведение животного стремится максимизировать выживание “генов этого поведения” независимо от того, находятся ли гены этого поведения в организме животного, данное поведение осуществляющего” (Докинз, 2010, с. 393).
[Здесь надо продолжить «…только в том случае, если выживание «эгоистичных генов» посредством данного способа (морфологии, биохимии, поведения — той же манипуляции) будет «прибыльней» выживания посредством всех прочих возможных способов, и в первую очередь способа «ничего не менять». Ведь кроме «выигрышей» (benefit), ожидаемых от приспособлений вроде манипуляции, их выработка отбором с т.з. социобиологов предполагает «плату», связанную, например, с дополнительной элиминацией особей, снижающих эффективную численность популяции, с затратами на перестройку физиологии-биохимии у «лучше манипулирующего» паразита и пр. (cost).
И именно с т.з. социобиологии «выигрыш» от выживания через данное поведенческое изменение должен превзойти «плату», чтобы «включить» вырабатывающий его отбор. Или, точней, отношение «выигрыша» к «плате» у данного поведенческого приспособления выше, чем у его возможных альтернатив, включая тот вариант поведения, что уже присутствует в популяции до начала отбора. Т.е. отбор «включается» лишь для выработки «самых прибыльных приспособлений», а не любых возможных. Это — крупнейшее методическое достижение социобиологии, позволившее сравнивать поведенческие альтернативы, жизненные стратегии, и т.д. «точки приложения» и продукты отбора в своего рода единой валюте «прибыльности в итоговой приспособленности» (inclusive fitness), определяющей вероятность реализации «с точки зрения ультимативных механизмов».
Последние резко разнятся по своего рода «сила притяжения» соответствующих направлений развития к аттрактору «максимума inclusive fitness«, который — и здесь социобиологи снова правы — организации не обойти. Другое дело, что следование этим филогенетическим траекториям — или нет, в отличие от «скорости продвижения», коль последнее уже началось, определяется не ультимативными, а проксимальными механизмами (в чём моё расхождение с социобиологами).
Но даже с их точки зрения не всякая потенциально выигрышная манипуляция будет создана: чтобы отбор «заработал» именно в эту сторону, она должна быть «прибыльней» как минимум текущего состояния «без манипуляции», когда соответствующие поведенческие, морфофизиологические и биохимические феномены существуют просто в виде последствий инициирования и реакции тканей хозяина на жизнедеятельность паразита. Забыв этот важный момент, авторы (как и прочие социобиологи) наивно надеются, что отбор обязательно «усилит», «отшлифует» и «отточит» те последствия паразитирования, что потенциально способны дать манипуляцию. Нет, многие из них так и останутся просто последствиями, именно потому что выработать приспособления отбору «обойдётся дороже», чем не менять ситуацию вообще.
Такие надежды — обычный пример разобранных раньше «ошибок «от логики»: коль есть универсальный механизм формообразования — естественный отбор, и есть возможная точка его приложения, он обязательно включится и «сделает дело», независимо от особенностей меняющейся организации, экологических обстоятельств её изменения и пр. Такая ошибка повсеместна у социобиологов (см. пример с human oestrus). Она создана умонастроением панадаптационизма («парадигма Панглосса»), вообще говоря, несовместным с аналитическим инструментарием данной дисциплины и, увы, часто «выключает» использование последнего — по тем же причинам, по которым позитив от «удачного объяснения» сложной ситуации выключает трезвый скепсис, требующий проверить и взвесить «а оно точно проходит? нет ли другого?». См. «дело о женском оргазме» (его происхождении). Увы, и у Гопко с Михеевым выключило, хотя многие из разобранных ими случаев говорят о необходимости такого трезвения.
Фактически выше Докинз «забыл» о правилах анализа реальности, предложенных своей собственной концепцией, «поддавшись» парадигме Панглосса. А авторы статьи наступили на те же грабли, поддавшись авторитету Докинза. Прим.публикатора]
Манипуляции паразита являются одним из типичных примеров этой концепции, поскольку гены, управляющие проявлением фенотипического признака (например, реакции рачка на свет), находятся в двух разных “машинах выживания” — организме хозяина и организме паразита (Poulin, 2010; Hughes, 2014; Heil, 2016).
Со времени первых работ В. Бетла, Дж. Холмса и Р. Докинза прошло уже несколько десятилетий и за это время паразитические манипуляции превратились в общепринятую и хорошо устоявшуюся научную концепцию (Poulin, 2010). Если поначалу манипуляции поведением хозяина воспринимались как нечто исключительное (Hughes, 2014), то к настоящему моменту принято считать, что они весьма распространены в природе и едва ли не первыми привлекаются в качестве объяснения изменений в поведении хозяина (Parker et al., 2009; Poulin, 2010; Weinersmith, Faulkes, 2014; Moore, 2013).
Адаптивность манипуляций
В 1980-е годы изменения в поведении хозяина было принято рассматривать с точки зрения трех не исключающих друг друга гипотез. Изменения в поведении могли считаться адаптацией паразита — собственно манипуляция, адаптацией хозяина — попыткой избавиться от инфекции и/или ослабить ее негативное влияние на организм и, наконец, просто побочным эффектом инфекции (Moore, 2013). Последнюю гипотезу, кажущуюся на первый взгляд привлекательной, в последнее время все чаще принято отбрасывать, как непродуктивную и не выдерживающую проверку в эксперименте (Moore, 2013). Как ни странно, но при пристальном изучении изменения в поведении зараженного животного, как правило, оказываются адаптацией либо хозяина, либо паразита. Изначальная популярность гипотезы “побочного эффекта инфекции”, вероятно, связана с традиционным биомедицинским взглядом на паразитов как на нечто чуждое, неестественное и вредное. Однако по мере распространения адаптационистских и эволюционистских взглядов на взаимоотношения паразита и хозяина в измененном фенотипе зараженного животного все чаще стали искать и находить адаптации одной из сторон биологического взаимодействия (Мооге, 2013).
[И ведь упорно не видят, что тут нет ничего хорошего, см.выше!]
Согласно современному определению адаптивным считается тот фенотип, который в данных условиях окружающей среды обеспечивает максимальную приспособленность по сравнению с определенным набором альтернативных фенотипов (Lefevre, Thomas, 2008). Другими словами, любые изменения фенотипа хозяина, ведущие к повышению приспособленности паразита, будут поддерживаться отбором и потому являются адаптациями (Lefevre, Thomas, 2008; Poulin, 2010). Действительно, даже если вначале изменения фенотипа хозяина и являются побочным эффектом инфекции, то в дальнейшем естественный отбор будет благоприятствовать тем из них, которые адаптивны, скажем, для паразита, в то время как неадаптивные фенотипические изменения будут элиминироваться (Докинз, 2010, с. 362; Lefevre, Thomas, 2008).
[Напрочь забыта ещё одна категория: адаптивные, но требующие большей «платы», чем текущее состояние побочных эффектов инфекции. А ведь коли оба вида, паразит и хозяин, успешно осуществляют каждый свой жизненный цикл, организация обоих уже адаптивна. И новый отбор, «вырабатывающий манипуляции», включится дополнительно лишь при большей их «прибыльности», «от добра добра он не ищет». Прим.публикатора]
Таким образом, в устоявшейся системе паразит —хозяин, т.е. если паразит и хозяин коэволюционировали достаточно долго, шансы обнаружить побочный эффект инфекции, не подвергавшийся давлению естественного отбора, невелики.
[Вообще, в данном разделе явное противоречие теории авторов, требующей «отбора на уровне генов», и сделанных ими утверждениях о фактах. Неслучайно дальше в статье много разного и интересного о приспособлениях, и совсем ничего — о «генах», которые их хотя бы обуславливают, не говоря уж об «эгоистичных репликаторах» в смысле Докинза, которые их используют «как машину для собственного воспроизводства». Интересно, авторы видят эту невязку с эмпирией у любимой теории? Прим.публикатора.]
Провести четкую грань между фенотипическими изменениями, адаптивными для паразита и хозяина оказывается не так просто по нескольким причинам. Во-первых, не все системы паразит — хозяин удобны для экспериментальной проверки каждого из этих предположений (Moore, 2013). Во-вторых, одно и то же фенотипическое изменение может оказаться одновременно и приспособлением паразита, и приспособлением хозяина. Например, стремление многих насекомых, зараженных паразитами, искать открытые возвышенные и хорошо освещенные солнцем участки может быть объяснено двумя не исключающими друг друга способами (Moore, 2013). С одной стороны, такое поведение делает насекомое более заметной жертвой для следующего хозяина, что выгодно паразиту. С другой стороны, хозяин может оставаться на солнцепеке, чтобы искусственно повысить температуру своего тела и попытаться избавиться от инфекции, поскольку температурная выносливость паразита может быть ниже таковой хозяина (Lefevre, Thomas, 2008; Moore, 2013). Аналогичная смена температурных предпочтений обнаружена также у других видов животных, например, моллюсков (Wesolowska, Wesolowski, 2013) и рыб (Macnab, Barber, 2011). Есть, однако, ряд теоретических рассуждений, свидетельствующий в пользу того, что фенотипические изменения будут гораздо чаще оказываться манипуляциями паразита, а не защитными приспособления хозяина.
Во-первых, жизненный цикл паразита, как правило, короче жизненного цикла хозяина, а численность оставленного им потомства гораздо выше. Таким образом, паразиты способны эволюционировать и вырабатывать адаптивные черты быстрее, чем их хозяева (Sorensen, Minchella, 2001). Второй, более фундаментальный аргумент, связан с применением принципа “жизнь — обед” к эволюционной “гонке вооружений” в системе паразит —хозяин (Dawkins, Krebs, 1979; Докинз, 2010, гл. 4; Lefevre, Thomas, 2008).
[Он неверен, т. к. при прочих равных затраты сторон в эволюционной гонке вооружений сопоставимы, а развивается она за счёт асимметричности «ответов» и «вызовов», при несовершенстве каждой из адаптаций, всегда оставляющей «ахиллесову пяту» в структуре приспособлений. Прим.публикатора]
Под эволюционной гонкой вооружений понимают ситуацию, когда две филогенетические линии (два вида, две четко различимые группы внутри вида и т.п.) коэволюционируют вместе на протяжении долгого времени, причем в ответ на адаптации одной линии другая вырабатывает контрадаптации. Совсем уж строго говоря, в гонке вооружений участвуют два набора коэволюционирующих генов, но здесь мы не будем вдаваться в излишнюю детализацию (Dawkins, Krebs, 1979; Докинз, 2010).
Участниками эволюционной гонки вооружений могут быть паразит — хозяин, хищник — жертва, два конкурента за один и тот же пищевой ресурс, самцы и самки, инвазионные и неинвазионные особи паразитов и т.п. Гонка вооружений может быть симметричной и асимметричной в зависимости от того, одинаково ли направление отбора, действующего на участников (Dawkins, Krebs, 1979; Докинз, 2010). Например, два вида деревьев, конкурирующих в лесу за солнечные лучи, вовлечены в симметричную гонку вооружений, поскольку отбор в этом случае влияет на схожие фенотипические черты у каждого из конкурентов [Нет, в той мере, в какой у них разная структура кроны и мозаика размещения листовых поверхностей в соответствующем объёме, а это именно то чем различаются разные виды деревьев]. В асимметричной гонке вооружений давление отбора влияет на очень несхожие фенотипические черты каждого из участников. Например, давление отбора на хищников, совершенствующее их навыки погони, ловли и убийства, иное, чем давление на жертв, поскольку жертвы совершенствуют в ходе эволюции совершенно иные адаптации: избегание, уклонение, маскировку и т.п.
В гонках вооружений нередка ситуация, когда давление отбора на одну из сторон конфликта сильнее, что позволяет этой стороне развивать более совершенные адаптации и находиться в эволюционной гонке несколько впереди (Dawkins, Krebs, 1979; Докинз, 2010). Принцип “жизнь —обед” как раз иллюстрирует ситуацию, когда давление отбора на одну из сторон в эволюционной гонке вооружений сильнее, чем на другую. Этот принцип получил свое название от изречения Эзопа, написавшего, что заяц бежит быстрее лисицы, поскольку борется за свою жизнь, в то время как она только за свой обед. Другими словами, в некоторых гонках вооружений последствия неэффективно сработавшей адаптации значительно серьезнее для одной стороны, чем для другой. Лисица, не догнавшая зайца, способна после этого оставить потомство и передать свои гены в следующее поколение, в то время, как гены проигравшего в забеге зайца уже никогда не перейдут к его потомкам. Стоит заметить, что принцип “жизнь — обед” вовсе не утверждает, что давление отбора на жертву будет всегда сильнее, чем давление отбора на хищника, как в приведенном выше гипотетическом примере (Докинз, 2010, с. 121—124).
В системе паразит — хозяин давление на паразита, как правило, сильнее, поскольку для паразита-манипулятора попадание в организм следующего хозяина — всегда вопрос жизни и смерти, в то время как для хозяина это не обязательно так (Lefevre, Thomas, 2008). Любой потенциальный хозяин паразита происходит от очень длинной линии предков, многие из которых никогда не встречались с угрозой паразитизма. Более того, многие из организмов-хозяев оставляли потомство до, а иногда и после заражения паразитами. Таким образом, даже у тех генов хозяина, которые не были способны обеспечить эффективную защиту от паразитической угрозы, было немало шансов передаться потомству. Напротив, любой паразит происходит исключительно от тех предков, которые эффективно и успешно решили проблему переноса от одного хозяина к другому (Lefevre, Thomas, 2008). Следовательно, гены хозяина, увеличивающие шансы паразита попасть в организм следующего хозяина, например, гены, отвечающие за манипуляцию, имеют больше шансов закрепиться в генофонде. Хотя в результате эволюционной гонки вооружений “равновесный” фенотип хозяина будет представлять собой нечто промежуточное между оптимальными фенотипами с точки зрения паразита и с точки зрения хозяина, равновесие в системе будет, как правило, смещено в сторону паразитического оптимума из- за большего давления отбора на паразита (Lefevre, Thomas, 2008). Таким образом, обнаружив изменения в поведении зараженного хозяина, мы с большой вероятностью можем утверждать, что столкнулись именно с манипуляцией паразита, а не защитной реакцией хозяина.
Распространенность паразитических манипуляций в природе
Тем не менее вопрос о распространенности паразитических манипуляций в природе остается дискуссионным. Вероятно, не все паразиты являются манипуляторами, однако, (1) какие факторы ограничивают распространение в популяции паразитов генов, отвечающих за манипуляции, и (2) какова доля паразитов-манипуляторов (Poulin, 2010; Ней, 2016)? Среди причин ограничивающих распространение манипуляций наиболее активно обсуждаются затраты на манипуляции. Изменение поведения хозяина, по всей видимости, требует от паразитов немалых затрат вещества и энергии, которые не обязательно окупаются (Poulin, 1994,2010; Brown, 1999; Brown et al., 2003; Poulin et al., 2005; Parker et al., 2009; Heil, 2016 Gopko et al., 2017b. Вопрос о затратах на манипуляции будет обсуждаться в отдельном разделе этой работы.
Хотя число примеров паразитических манипуляций в научной литературе уже исчисляется сотнями, по-прежнему неясно, какова доля видов-манипуляторов от общего числа паразитических видов. Сообщения об отсутствии у каких-то видов паразитов способности к манипуляции относительно редки, но, по всей видимости, это отчасти объясняется нежеланием многих исследователей и научных журналов публиковать отрицательный результат исследования (Poulin, 2010).
[а также вышеизложенной адаптационистской парадигмой, когда всякие изменения после заражения паразитом интерпретируются как «манипуляция», т. к. их выгодность при известной изворотливости ума всегда можно аргументировать, а нуль-гипотеза, что это побочные следствия инфекции, специально не проверяется и не опровергается. Прим.публикатора].
Кроме того, в литературе безусловно встречаются примеры, как “ложноположительных”, так и “ложноотрицательных” примеров манипуляций (Heil, 2016). Ошибочное приписывание паразитам манипуляций может быть связано с недостаточным вниманием к альтернативным объяснениям изменений в поведении хозяина или неаккуратно проведенными экспериментами.
С другой стороны, из того факта, что исследователю не удалось обнаружить манипуляцию в своих экспериментах, вовсе не следует, что паразит, которого он изучал, не является манипулятором. Ученый естественным образом ограничивается лишь небольшим набором поведенческих черт, которые могут меняться под воздействием паразита. Разумеется, нельзя быть уверенным, что для своих манипуляций паразит выбирает именно эти черты. Кроме того, успешная манипуляция вовсе не обязательно должна бросаться в глаза (Heil, 2016). Иногда цель манипуляции сделать зараженного хозяина не отличимым от незараженных особей (Heil, 2016). Например, для паразитов способных горизонтально переноситься от хозяина к хозяину, скажем, возбудителей заболеваний, передающихся половым путем, важно, чтобы зараженная особь не проявляла признаков слабости и не теряла своей привлекательности для потенциальных половых партнеров (Heil, 2016). Это особенно актуально, учитывая, что многие животные активно при спаривании выбирают менее зараженных или более устойчивых к паразитам партнеров (Hamilton, Zuk, 1982; Hamilton et al., 1990). В таком случае, если паразит оказывается способен сделать своего хозяина хотя бы не менее привлекательным для полового партнера по сравнению с незараженной особью, то манипуляцию поведением хозяина можно считать успешной (Heil, 2016). Это вовсе не значит, что зараженное животное не отличается от незараженного. Успех в привлечении полового партнера может быть достигнут путем многократного увеличения производства половых феромонов в организме хозяина по сравнению с незараженными особями (Dass et al., 2011; Vyas, 2013; Heil, 2016), однако в чисто поведенческих тестах такая манипуляция останется незамеченной.
Вообще, паразитические манипуляции, которые не могут быть обнаружены визуально, как правило, выпадают из поля зрения исследователей, и сведения о таких манипуляциях крайне скудны (Moore, 2013). Вероятнее всего это связано с той огромной ролью, которую зрение играет в восприятии человека. Большую часть окружающих нас явлений мы замечаем зрительно, в то время как для паразитов и их хозяев, если это не Homo sapiens, зрение может не играть существенной роли и уступать первенство другим способам воспринимать окружающую действительность. Здесь следует упомянуть такое понятие, как “перцептивный мир” (Umwelt), предложенное Якобом фон Икскюлем (Мооге, 2013). Под ним подразумевается тот окружающий мир, который живое существо способно воспринять с помощью своих органов чувств. Для иллюстрации своей идеи Икскюль использовал эктопаразитических кровососущих клещей. Он заметил, что в поисках пищи клещи реагируют всего на три стимула, причем строго в перечисленном ниже порядке: запах масляной кислоты, температура близкая к 37°С (температуре тела теплокровного животного) и строение волосяного покрова на теле потенциального хозяина (Мооге, 2013). Остальные стимулы не существенны и, вероятно, даже не воспринимаются. Человек и клещ могут находиться в одном и том же уголке леса в один и тот же момент, человек может даже быть для клеща источником пищи, но в то же время их восприятия окружающего мира практически не будут пересекаться (Мооге, 2013).
Для того чтобы полностью исчерпать возможности паразита манипулировать фенотипом своей жертвы и с уверенностью отвергнуть гипотезу манипуляции, необходимо очень глубоко “проникнуть” в перцептивные миры хозяина и паразита. Зачастую такое проникновение приводит к обнаружению новых и неожиданных адаптаций паразита, таких как упомянутое выше использование химических стимулов (половых феромонов) для привлечения хозяина. Еще более яркий пример перцептивного мира, не относящийся напрямую к манипуляциям, способность паразитических тахин (Ormia ochracea) обнаруживать своих жертв — сверчков — по характерному стрекотанию. Необходимость избегать таких паразитов привела к тому, что на нескольких островах Гавайского архипелага, куда вселилась паразитическая тахина, сверчки почти полностью перестали стрекотать буквально за несколько десятков поколений (Zuk et al., 2006). Без проникновения в перцептивный мир паразита исследователям было бы трудно понять, почему на некоторых островах Гавайского архипелага путешественника вместо привычного стрекотания встречает почти полная тишина.
По всей видимости, именно исследование манипуляций, затрагивающих фенотипические черты хозяев, не заметные для человеческого глаза, является одним из наиболее интересных направлений дальнейших исследований. Впрочем, далеко не единственным.
В завершение отметим, что, хотя вопрос о распространенности паразитических манипуляций далек от окончательного решения, в настоящий момент принято считать, что встречаются как паразиты-манипуляторы, так и виды (и даже группы в рамках одного и того же вида) не манипулирующие поведением хозяина (Poulin, 2010). При этом несомненно, что манипуляции являются весьма распространенным природным феноменом и число манипуляций, не попавших в поле зрения исследователей, вероятно, весьма велико (Poulin, 2010; Мооге, 2013; Ней, 2016).
Несостоявшийся “кризис жанра” и новые направления исследований
Необходимо сказать несколько слов о том, в каком направлении развивается изучение паразитических манипуляций в последние годы и какую роль играет манипуляторная тематика в современной эволюционной, поведенческой и экологической науке. Любопытно, что почти два десятилетия назад известный паразитолог Пулен высказал предположение (Poulin, 2000), что интерес к концепции паразитических манипуляций начинает “выдыхаться”. Проведенный им мета-анализ показал, что с начала 1970-х годов, когда паразитические манипуляции впервые попали в поле зрения ученых, по конец 1990-х, статистический размер эффекта (effect size) в работах, посвященных манипуляциям, имел тенденцию к снижению. Объяснить это явление можно было как исчерпанием самого предмета исследований, так и потерей интереса научного сообщества к этой теме, т.е. выходом ее из моды (Poulin, 2000).
Однако 16 лет, прошедших со времени выхода этой работы, характеризовались бурным всплеском интереса к паразитическим манипуляциям фенотипом хозяина. Были обнаружены новые впечатляющие примеры этого феномена (см. Seppala et al., 2004, 2005; Yanoviak et al., 2008; Mikheev et al., 2010; Maure et al., 2011, 2013 и пр.). Намечены совершенно новые направления исследований, например манипуляции паразитов фенотипом растений (Ней, 2016), манипуляции неинвазионных паразитов (Parker et al., 2009; Dianne et al., 2011; Hafer, Milinski, 2015; Gopko et al., 2015), конфликт и кооперация паразитов-манипуляторов в организме хозяина (Thomas etal., 2005; Hafer, Milinski, 2016; Weinersmith et al., 2014; Gopko et al., 2017b). Паразитические манипуляции все больше интересуют матбиологов и мета-аналитиков, пытающихся предсказать условия, при которых манипуляция может быть поддержана естественным отбором, каких стратегий манипулирования придерживаются паразиты на разных этапах своего жизненного цикла, как физиологические механизмы контроля над поведением хозяина отличаются у паразитов-генералистов и паразитов-специалистов (Fenton, Rands, 2006; Parker et al., 2009; Vickery, Poulin, 2010; Fredensborg, 2014). Наконец, только в последние несколько лет экологи оценили, какую важную роль паразиты в целом и паразитические манипуляции в частности могут играть в различных экосистемах, сближая трофические уровни, ускоряя перенос вещества и энергии по трофическим цепям, а подчас и являясь важным пищевым ресурсом для других живых существ (см. разд. IV этого обзора).
II. Основные стратегии манипулирования. “Классическая манипуляция” (манипуляция неинвазионных паразитов)
Жизненные циклы паразитов разнообразны, и столь же разнообразны могут быть их стратегии манипулирования. В этом разделе мы кратко опишем, какие цели может паразит преследовать своей манипуляцией в зависимости от особенностей его жизненного цикла, и подробно остановимся на манипуляциях паразитов, передающихся по трофической цепи.
Паразитов можно разделить на две категории. Одни способны провести всю жизнь на одном хозяине или на одном виде-хозяине (моноксенные паразиты), т.е. в относительно постоянных условиях. Другим для завершения жизненного цикла необходима смена видов-хозяев (гетероксенные паразиты) или же они часть жизни проводят, паразитируя на других организмах, а другую часть — как свободноживущие организмы (паразитоиды). Гетероксенные паразиты и многие паразитоиды резко меняют условия обитания в ходе своего жизненного цикла. Стратегии манипулирования этих категорий паразитов могут существенно различаться (Poulin, 2010; Михеев, 2011).
Манипуляции моноксенных паразитов
Хотя моноксенный паразит может провести всю жизнь на одном индивидууме, это вовсе не означает, что ему за время своей жизни не нужно сталкиваться с другими представителями вида-хозяина. Такая необходимость может возникнуть, если паразит или его потомство передается следующему хозяину при непосредственном контакте, например половым путем, при прикосновении или укусе. Теоретически такие паразиты заинтересованы в большей частоте контактов между особями вида-хозяина, т.е. манипулируют зараженным хозяином так, чтобы он как можно активнее искал контактов с другими особями своего вида (Dawkins, 1999; Lefevre, Thomas, 2008; Poulin, 2010; Михеев, 2011). Несмотря на логичность подобного предположения, примеров таких манипуляций обнаружено немного, вероятно, из-за недостаточной изученности вопроса (Poulin, 2010; Heil, 2016). Известна, однако, способность передающихся половым путем паразитов увеличивать сексуальную привлекательность своего хозяина (см. подробный обзор примеров в Heil, 2016). Например, такой распространенный, в том числе и в человеческой популяции, паразит, как Toxoplasma gondii (Flegr et al., 2014a, b) увеличивает выработку половых гормонов у самцов крыс, делая их более сексуально привлекательными для самок (Dass et al., 2011). При этом известно, что у крыс, кроликов, овец, собак, а возможно, и у людей токсоплазмоз способен передаваться половым путем (Flegr et al., 2014а, Heil, 2016). Тем самым увеличение частоты половых контактов носителя инфекции повышает и шансы паразита заразить нового хозяина.
Известный пример манипуляций, связанных с половым поведением, обнаружен в системе паразитический гриб (Entomophthora muscae) — комнатная муха (Musca domestica) (Moller, 1993). Споры Е. muscae прорастают гифами в абдомене мухи, приводя к смерти хозяина. Мухи часто умирают на открытых местах, оказываясь хорошо заметными для других представителей своего вида. Даже мертвые они по какой-то причине сексуально привлекательны для других особей того же вида, в первую очередь самцов (Moller, 1993). Несмотря на то что погибшая от инфекции муха окружена пучками конидий, она является источником каких-то зрительных или химических стимулов, которые заставляют других мух приближаться к ней, касаться ее и в конечном итоге с очень большой вероятностью (> 90%) заражаться спорами гриба-энтомофага (Moller, 1993). Еще один патоген, предположительно манипулирующий поведением хозяина с целью увеличить частоту его контактов с другими особями своего вида, возбудитель бешенства Rabies lyssavirus. Именно с манипуляциями иногда связывают повышенную активность и агрессивность животного (Dawkins, 1999; Lefevre, Thomas, 2008; Poulin, 2010). Впрочем, повышенная агрессивность далеко не единственная форма проявления бешенства и для того, чтобы подтвердить гипотезу манипуляции поведением зараженного животного требуются дополнительные исследования (Poulin, 2010).
В некоторых случаях моноксенным паразитам необходимо покидать своего хозяина для поиска полового партнера или откладки яиц. Так, поступают например эктопаразитические рачки р. Argulus, обитающие на коже рыб. Хотя аргулюсы облигатные паразиты и во взрослом состоянии питаются исключительно тканями и кровью хозяина (Mikheev et al., 2000; Walker et al., 2011), они всю жизнь сохраняют способность к активному плаванию и часто меняют хозяев (Mikheev et al., 2015). Логично предположить, что паразиту также выгодно, чтобы зараженная им рыба держалась ближе к другим рыбам в стае. Показано (Михеев, 2011), что в стаях радужных форелей (микижей), зараженных Argulus foliaceus, рыбы предпочитали держаться ближе друг другу по сравнению с контрольными стаями, состоящими из незараженных рыб. Кроме того, рыбы, зараженные аргулюсом, значительно снижали скорость плавания и становились менее агрессивными по сравнению с контрольными рыбами (Михеев, 2011). Вероятнее всего, эти изменения в социальном поведении микижи вызваны выделением в воду веществ тревоги из клеток, поврежденных рачком при питании (Mikheev et al., 2015). Таким образом, в этом случае паразит использует поведенческие механизмы, обычно служащие рыбам для защиты от хищников, чтобы изменить групповое поведение рыб к собственной выгоде.

Сосательный аппарат и присоски, с помощью которых рачок-карпоед Argulus foliaceus прикрепляется к телу рыб. Фото с сайта http://www.aquarienfotografie.net
Наконец, в тех случаях, когда моноксенный паразит не делает ставку на непосредственный контакт между хозяевами для передачи инфекции, он может тем не менее менять место его обитания (habitat niche), чтобы увеличить шансы заразить других хозяев. В качестве примера можно выбрать уже упомянутый ниже паразитический гриб Е. muscae и еще одного его хозяина — навозную муху (Scathophaga stercoraria). Зараженные мухи перед смертью занимают положение, наиболее благоприятное для распространения спор гриба (Maitland, 1994). Они прочно прикрепляются к нижней стороне листа близко к его кончику. При этом местом своего упокоения зараженные мухи, как правило, выбирают относительно большие, возвышающиеся над другими травянистые растения, умирая поблизости от их верхушки. Наконец, они соотносят место, где замирают перед смертью, с розой ветров, располагаясь преимущественно с подветренной стороны побега (Maitland, 1994).
Для сравнения: здоровые мухи предпочитают ползать по верхней поверхности листа, в основном обитают на низкорослых травянистых растениях, а вокруг растений и на них они распределены случайным образом, т.е. направление ветра для них несущественно (Maitland, 1994). Предполагается, что паразит манипулирует предсмертным поведением своего хозяина, чтобы после смерти он оказался максимально эффективным распространителем спор гриба. Кроме того, расположение на нижней стороне листа, вероятно, способствует созданию оптимальных условий для развития спор (локальное повышение влажности) и защищает паразита от смывания на землю дождем (Maitland, 1994).
Пожалуй наиболее известным примером моноксенного паразитического гриба-манипулятора служит Ophiocordyceps unilateralis — группа видов, поражающая различных тропических муравьев. Вызванные этим патогеном поведенческие изменения настолько впечатляющи, что зараженные О. unilateralis муравьи получили в научной литературе название — “муравьи-зомби” (zombie-ants) (Hughes et al., 2011b; Evans et al., 2011; Weinersmith, Faulkes, 2014). Заражение начинается с того, что спора гриба попадает на поверхность экзоскелета муравья и проникает внутрь тела хозяина, сочетая механическое давление и химическое (смесь ферментов: хитиназ, липаз и протеаз) воздействие на его покровы и успешно избегая его защитных механизмов (Evans et al., 2011). В дальнейшем дрожжеподобные клетки распространяются по телу хозяина и прорастают гифами, особенно сильно разрастаясь в головной капсуле муравья, что играет ключевую роль в успехе последующей манипуляции его поведением (Hughes et al., 2011b). На этом этапе инфекция протекает бессимптомно.

Рис. 1. Муравьи-древоточцы, убитые паразитическим грибом Ophiocordyceps unilateralis в природе (на изображениях A и B видны грибы, выросшие из затылков жертв) и в лаборатории (D, E). A, D — муравьи Camponotus castaneus, B, E — C. americanus. C — культура паразитического гриба, полученная из зараженной особи C. castaneus. Изображение из обсуждаемой статьи в BMC Evolutionary Biology
Спустя несколько дней паразит начинает выделять в гемоцель муравья вещества, которые заметно меняют его поведение (Evans et al., 2011). Муравей покидает свою колонию в кроне дерева и спускается во влажный подлесок, чего здоровые муравьи обычно не делают. Любопытно, что поведенческие изменения у всех муравьев синхронизированы и приурочены к довольно короткому промежутку времени (двум предполуденным часам и полудню), словно паразит включает в организме хозяина будильник (Hughes et al., 2011b). Оказавшись в подлеске, зараженный муравей начинает мучительное путешествие в поисках места, наиболее подходящего для дальнейшего развития паразита. Несмотря на периодические спазмы, он может миновать несколько невысоких растений и “исследовать” несколько десятков и даже сотен (до 239) листьев в поисках подходящего (Hughes et al., 2011b)
Определившись с выбором, он забирается на абаксиальную, т.е. внешнюю по отношению к центральной оси побега сторону листа, и впивается в его центральную жилку (Andersen et al., 2009; Hughes et al., 2011b). Затем мышечные ткани челюстей муравья быстро дегенерируют, причем за процесс атрофии, видимо, ответственны гифы гриба, обильно обволакивающие мозг и мышечные волокна хозяина. После этого муравей, хотя и остается в живых еще несколько часов, уже не способен разомкнуть челюсти, хватка которых становится мертвой (Hughes et al., 201 lb). После смерти муравья гифы гриба полностью опутывают тело хозяина, мумифицируя его и прочно прикрепляя к субстрату, а спустя несколько недель плодовое тело О. unilateralis прорастает через его головную капсулу, тем самым завершая жизненный цикл паразита (Evans et al., 2011). Остается заметить, что “мертвая хватка” зараженного муравья настолько сильна, что преодолевает геологические эпохи. Характерные отверстия, оставленные на листе мандибулами муравья, были обнаружены в окаменелости возрастом почти 50 млн лет (Hughes et al., 2011а).
В завершение отметим, что, несмотря на эффектность приведенных выше примеров, манипуляции моноксенных паразитов изучены в целом меньше, чем гетероксенных. Например, количество убедительных примеров манипуляций паразитов, передающихся при непосредственном контакте (укус, касание, половой акт), до сих пор невелико. То же справедливо и для паразитов, передающихся половым путем (Poulin, 2010; Ней, 2016). Неясно, свидетельствует ли обнаруженный паттерн о недостаточной изученности вопроса или же имеет под собой более глубокие эволюционные основания. Например, давление отбора на паразитов, передающихся при непосредственном контакте, может быть не столь велико: вероятность передачи инфекции достаточно высока и при обычном, не измененном паразитом поведении хозяина (Poulin, 2010).
Манипуляции паразитоидов и гетероксенных паразитов
Стратегии манипулирования паразитоидов и гетероксенных паразитов разумно рассматривать совместно (Poulin, 2010), поскольку жизненный цикл этих организмов характеризуется одной важной общей чертой. И те, и другие в ходе своего жизненного цикла резко меняют условия своего существования: паразитоиды переходят от жизни в организме хозяина к свободному существованию во внешней среде, а гетероксенные паразиты меняют хозяев, нередко заметно различающихся как по особенностям физиологии, так и по месту своего обитания. Например, жизненный цикл большинства видов трематод включает трех хозяев (Galaktionov, Dobrovolskij, 2003). Так, для D. pseudospathaceum и Euhaplorchis califomiensis — двух известных трематод-манипуляторов — первыми промежуточными хозяевами служат брюхоногие моллюски, вторыми — рыбы, а окончательными — рыбоядные птицы (Seppala et al., 2004; Lafferty, Morris, 1996). Другими словами, чтобы успешно завершить свой жизненный цикл, этим трематодам нужно побывать в организмах животных, относящимся к двум разным типам, и сменить среду своего обитания с водной на воздушную. Для решения этой задачи паразитам требуется большой набор адаптаций, к числу которых относятся и изменение фенотипа хозяина.
Вероятно, именно поэтому среди паразитоидов и гетероксенных паразитов обнаружено большинство видов-манипуляторов (Poulin, 2010). Пулен (Poulin, 2010) предложил выделить несколько стратегий, в которые хорошо укладывается большинство примеров манипулирования, обнаруженных к настоящему моменту. Ниже его классификация дается с некоторыми изменениями — например, мы отдельно описали манипуляции моноксенных паразитов (см. выше) и не будем к ним возвращаться.
Первую стратегию применяют паразитоиды, резко меняющие условия обитания в ходе своего жизненного цикла. Как правило, этот переход сопряжен со смертью хозяина, причем, что характерно, время и/или место смерти обычно точно определяется паразитом (Maure et al., 2011). В этом смысле манипуляции паразитоидов во многом напоминают описанные выше манипуляции моноксенных паразитов. Цель манипуляции многих паразитоидов — заставить хозяина кардинально изменить место своего обитания зачастую на совершенно неподходящее. Хорошим примером служат волосатики (Nematomorpha, класс Gordoidea), личинки которых обитают в теле насекомых, в то время как взрослые стадии этих червей — свободноплавающие животные. Взрослые особи волосатика выметывают яйца в воду, где в течение 2—4 нед из них развиваются личинки. Личинки не способны к активному плаванию и могут быть проглочены различными водными животными. Многие из этих животных оказываются неподходящими хозяевами для паразита — тупиковыми хищниками (deadend predators (Seppala et al., 2008)) (Hanelt et al., 2016, nematomorpha.net). Другие организмы, например личинки водных насекомых, служат волосатикам дополнительными хозяевами (Biron et al., 2005 а; Thomas et al., 2002).
Оказавшись в организме такого хозяина черви инцистируются и в таком состоянии способны пережидать продолжительное время. Со временем личинка превращается во взрослое насекомое и оказывается на суше, где рано или поздно погибает, а ее тело может быть съедено окончательным хозяином. Так, сверчки Nemobius sylvestris, до трети рациона которых составляют мертвые насекомые, заглатывают цисты волосатика Paragordius tricuspidatus с пищей, и в их организме паразит развивается во взрослое животное — тонкого длинного червя, занимающего почти всю полость тела хозяина (Thomas et al., 2002; Biron et al., 2005a). Чтобы завершить свой жизненный цикл, волосатику необходимо вернуться в водоем. Очевидная сложность заключается в том, что сверчки — наземные животные и редко по своей воле оказываются в водоеме. Здесь и возникает необходимость манипулировать поведением хозяина, чтобы заставить его очутиться в воде. Тома с соавт. (Thomas et al., 2002) экспериментально показали, что зараженные волосатиком сверчки, помещенные рядом с наполненной водой кюветой, оказывались в воде достоверно чаще, чем незараженные сверчки. По всей видимости, волосатики химически воздействуют на нервную систему хозяина (показано на примере кузнечика Месопета thalassinum), заставляя его искать воду и в конечном итоге совершать акт суицида, бросаясь в водоем (Biron et al., 2005b).
Другой пример — паразитические перепончатокрылые — наездники. Здесь можно привести множество примеров манипуляций фенотипом хозяина, но мы ограничимся лишь двумя. Так, костариканский наездник Hymenoepimecis argyraphaga, относящийся к семейству ихневмонид, паразитирует на пауках Plesiometa argyra. Обычно эти пауки плетут большую ажурную паутину, в центре которой и подстерегают добычу (Eberhard, 2001). Наездник атакует паука, временно (на 10—15 мин) парализует его и откладывает яйцо на поверхность его брюшка (абдомена) (Eberhard, 2001). Яйцо плотно приклеивается к абдомену и вскоре из него выходит личинка наездника. Личинка проделывает несколько небольших отверстий в брюшке паука, через которые и питается гемолимфой хозяина. Кроме того, она, видимо, впрыскивает в организм паука какие-то химические вещества, которые в конечном итоге меняют его поведение. Однако в первые 7—14 дней после заражения эти изменения незаметны, и лишь в последнюю ночь перед окукливанием личинки наездника паук начинает вести себя иначе (Eberhard, 2000, 2001). Он начинает строить новую паутину, однако она совсем не похожа на ту ажурную ловчую сеть, что он строил раньше. Вместо этого он строит небольшой, но прочный каркас из нескольких толстых нитей и хорошо укрепляет его центр (Eberhard, 2000, 2001).

Найдите десять отличий! Слева паутина, сплетенная «обычным» пауком Plesiometa argyra, а справа его зараженным паразитом собратом. На правом фото хорошо заметен, свисающий из центра паутины кокон. Источник фото – Eberhard, 2001 (http://slideplayer.com/slide/6625943)
Когда работа паука завершена, личинка наездника убивает и поедает его. Затем она забирается в центр паутины, где плетет кокон, в котором окукливается, а еще через неделю из кокона выходит имаго наездника. Вероятно, цель манипуляции поведением хозяина защитить паразита от сильных тропических ливней, способных повредить кокон, в котором наездник проходит метаморфоз (Eberhard, 2000, 2001). Любопытно, что если в последнюю ночь перед смертью хозяина паразита удалить с абдомена паука, то хозяин выживает, но продолжает плести паутину неправильной формы еще в течение недели (Eberhard, 2001). Пo всей видимости, все это время паук находится под действием каких-то химических веществ, выделенных паразитом в его гемолимфу (Eberhard, 2001). Стоит отметить и то, как именно паразит меняет поведение хозяина. Он не заставляет паука делать нечто новое. Вместо этого паук совершает движения, очень похожие на плетение нормальной паутины, однако он не переходит от одного типа движений к следующему. Вместо этого он раз за разом повторяет одни и те же движения, что и приводит к появлению толстых, сотканных из множества тонких, наложенных одна на другую нитей. Другими словами, манипуляция заключается не в том, что паразит вызывает у хозяина экспрессию новых поведенческих черт, а в том, что он подавляет часть старых, необходимых для плетения нормальной паутины (Eberhard, 2000, 2001).
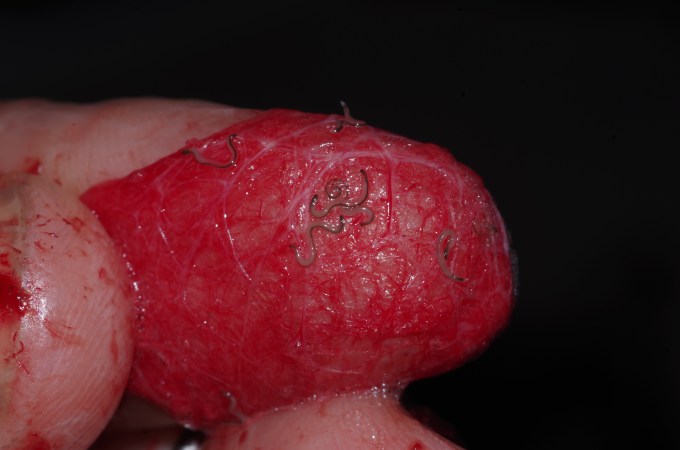
Другой пример — Dinocampus coccinellae, наездник, паразитирующий на божьих коровках, в том числе на особях вида Coleomegilla maculata. Наездник откладывает в гемоцель своей жертвы яйцо, из которого в течение примерно двадцати дней развивается личинка, готовая покинуть тело хозяина (Maure et al., 2011, 2013; Dheilly et al., 2015). В течение этого времени поведение божьей коровки остается обычным. Однако к моменту, когда личинка покидает организм хозяина, поведение хозяина меняется. Божья коровка становится малоактивной, почти неподвижной, но периодически все ее тело подрагивает (тремор). При этом личинка наездника окукливается между конечностями хозяина. Таким образом, божья коровка словно прикрывает своим телом куколку паразита. Спустя неделю, наездник завершает метаморфоз и улетает (Maure et al., 2011, 2013). Любопытно, что хозяин все это время остается живым, и теоретически может восстановиться после заражения паразитом и его манипуляции. В условиях лаборатории выживало до четверти божьих коровок, но трудно оценить, каковы шансы хозяина восстановиться после инфекции в естественных условиях (Maure et al., 2011). Такая невысокая вирулентность паразита для божьих коровок, возможно, связана с необычным механизмом манипуляции паразита.
Откладывая яйцо в божью коровку, наездник одновременно заражает ее вирусом (DcPV), обитающим в яйцеводе насекомого. Дальнейшие изменения в поведении хозяина связаны с воздействием на его организм вируса и реакцией иммунитета на этот вирус (Dheilly et al., 2015). Отметим, что опосредованное воздействие паразита на нервную систему хозяина через его иммунитет считается одним из способов манипулирования паразита поведением хозяина (Lafferty, Shaw, 2013; Cezilly et al., 2014), хотя говорить об этом с уверенностью трудно, поскольку в настоящий момент механизм манипуляций известен лишь для относительно небольшого числа систем паразит — хозяин.
Оба приведенных примера характерны тем, что паразит не просто использует ресурсы хозяина для собственного роста и развития, но и заставляет его выполнять функции телохранителя (bodyguard manipulations) (Maure et al., 2011, 2013). В первом случае хозяин защищает паразита косвенно, сплетая жесткий каркас, на который личинка наездника подвешивает свой кокон. Во втором случае божья коровка защищает паразита непосредственно своим телом. В обоих случаях цель манипуляции поведением хозяина — это защита наиболее уязвимых жизненных стадий паразита. Подобные защитные манипуляции относительно недавно привлекли внимание ученых. Однако есть основания полагать, что в природе они нередки (Parker et al., 2009). Более подробно они будут рассмотрены в разд. III (см. Манипуляции неинвазионных паразитов).
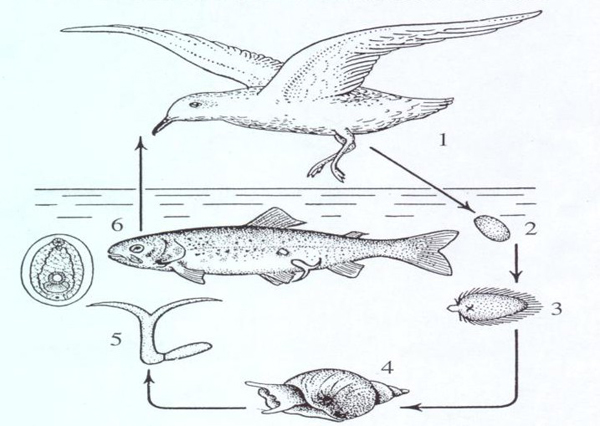
Вторая стратегия манипулирования применяется паразитами, использующими хозяина для производства и распространения своих расселительных стадий. Типичный пример — трематоды, промежуточным хозяином которым за редкими исключениями служит моллюск (Galaktionov, Dobrovolskij, 2003). В моллюска проникает покрытая ресничками личинка ми рацидий, которая превращается в материнскую спороцисту. Материнская спороциста дает начало либо дочерним спороцистам, либо редиям, которые способны путем апомиктического партеногенеза (Галактионов, 2016) производить мириады (до десятков тысяч в сутки) своих генетических клонов — церкарий (Lyholt, Buhmann, 1996; Taskinen, 1998; Soldanova et al., 2016). Для паразита это долгосрочный проект, поскольку моллюск может годами служить инкубатором для потомства паразита (Karvonen et al., 2006). Манипулируя фенотипом хозяина, такая трематода преследует несколько целей: во-первых, она старается максимизировать производство своих расселительных стадий, во-вторых, по мере возможности пытается уменьшить вероятность гибели хозяина в результате неблагоприятных внешних воздействий, скажем, хищничества, поскольку паразит заинтересован в том, чтобы эксплуатировать хозяина так долго, как это возможно, наконец, в-третьих, паразит стремится изменить поведение хозяина с целью увеличить свои шансы заразить следующего хозяина.
Чтобы увеличить производство своих расселительных стадий (у трематод — церкарий), паразит нередко кастрирует хозяина, направляя все ресурсы его организма на производство потомства паразита. Той же цели может служить и вызываемая паразитом смена пищевых предпочтений хозяина и гигантизм (Sorensen, Minchella, 2001; Докинз, 2010, гл. 12). Впрочем, гигантизм, наряду с утолщением и изменением формы раковины моллюска-хозяина, может служить и второй цели паразита — уменьшению риска быть съеденным (Докинз, 2010, гл. 12; Lafferty, 2008). Пока паразит находится внутри организма хозяина, гибель последнего почти неизбежно приведет и к гибели паразита (см. примеры того, как паразит умудряется ускользнуть из пищеварительного тракта хищника (Ponton et al., 2006)). Поэтому усиление защитных черт хозяина может быть адаптивным для паразита. Наконец, трематоды могут менять поведение и местообитание хозяина, чтобы увеличить шансы церкарий заразить следующего хозяина (Curtis, 1987). Так, трематода Gynaecotyla adunca заставляет своего хозяина — брюхоногого моллюска Ilyanassa obsoleta, обитающего на мелководье на западном побережье США, больше времени проводить на суше выше линии уреза воды. Подобное изменение поведения зараженной улитки, видимо, увеличивает вероятность встречи церкарий трематоды со следующими хозяевами паразита— полусухопутны ми ракообразными (Curtis, 1987).
Другой пример, трематода Cercaria batillariae, паразитирующая в улитке Batillaria cumingi. Этот моллюск — обитатель солоноватоводных маршей и илистых топей на северо-восточном побережье Евразии. В приливно-отливной зоне этого региона В. cumingi обычно оказывается наиболее многочисленным макроскопическим беспозвоночным и ее роль в экосистемах весьма значительна. Миура с соавт. (Miura et al., 2006) обнаружили, что особи В. cumingi, зараженные трематодами С. batillaria, предпочитают находиться на литорали ниже, по сравнению с незараженными. Такое наблюдение можно объяснить двояко: во-первых, паразиты могут манипулировать поведением хозяина, вынуждая его предпочитать больше времени проводить под водой и у воды, а во-вторых, особенностями передачи инфекции — вероятно, на нижней литорали рыбы чаще заражаются паразитами. Чтобы проверить, какая из этих гипотез верна, авторы статьи пометили сотни улиток водостойкой краской и выпустили примерно посередине приливно-отливной зоны. Спустя две недели, меченых улиток отлавливали и проверяли, как изменилось их положение по сравнению с началом эксперимента. Оказалось, что зараженные трематодой моллюски постепенно перемещались от начальной точки ближе к воде, в то время как незараженные, напротив, дальше от нее, т.е. выше по литорали (Miura et al., 2006).
Логичное объяснение подобного поведения — адаптация паразита. Следующими хозяевами С. batillaria служат рыбы, следовательно, чем больше времени улитка проводит под водой, тем больше вероятность того, что церкарии трематод, которые улитка производит, окажутся в подходящей для них среде и сумеют заразить следующего хозяина (Miura et al., 2006). Система Batillaria cumingi — Cercaria batillaria уникальна тем, что в ней обнаружен весь комплекс манипуляций фенотипом, описанный выше. Они и кастрируют хозяина, чтобы направить все потребляемые им ресурсы на собственное размножение, и меняют его морфологические черты (утолщение и изменение формы раковины, гигантизм), и влияют на его поведение (Miura et al., 2006).
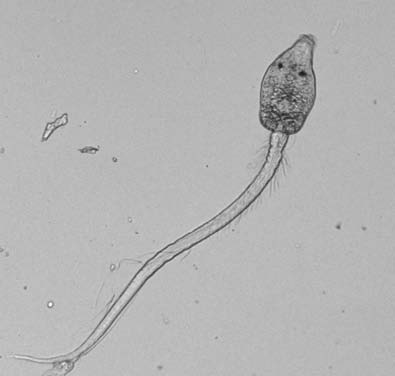
Церкарии трематоды Cercaria batillariae. В марши тихоокеанского побережья США проникла с инвазионным видом улиток Batillaria attramentaria; выделяясь из них, заражает местные виды рыб
Хотя не все системы паразит —хозяин изучены так детально, как Batillaria cumingi — Cercaria batillaria, в литературе можно обнаружить немало примеров адаптаций паразита к долгосрочному использованию хозяина для производства своих расселительных стадий. Так, несколько десятков примеров паразитарной кастрации и вызванного паразитом гигантизма приведено у Соренсена и Минчеллы (Sorensen, Minchella, 2001). Изменения в поведении моллюсков, вызванные трематодами, документировались несколько реже (Lowenberger, Rau, 1994; Levri, Lively, 1996; Miller, Poulin, 2001; Kamiya, Poulin, 2012; см. также Zbikowska, Zbikowski, 2015).
Третья стратегия возникает тогда, когда успех передачи инфекции, а в итоге и эволюционный успех паразита зависит от организма переносчика. Наиболее хорошо эта стратегия манипулирования изучена на примере малярийного плазмодия. К р. Plasmodium относятся более 200 видов простейших, паразитирующих в насекомых и позвоночных (List of Plasmodium species, Wikipedia: The Free Encyclopedia, 2016). Несколько родов кровососущих комаров служат плазмодию окончательным хозяином, а многие виды позвоночных (среди них рептилии, птицы и млекопитающие, включая приматов р. Homo) — промежуточным. Передача инфекции происходит при укусе комара, поэтому паразиту выгодно, чтобы насекомое более активно питалось кровью и атаковало больше потенциальных хозяев (Cator et al., 2012; Nyasembe et al., 2014). Следовательно, паразит должен менять поведение комара в сторону большей пищедобывающей активности. Эксперименты и полевые исследования показывают, что это, по всей видимости, соответствует истине (Cator et al., 2012). Так, комары, в слюнных железах которых содержатся спорозоиты плазмодия (стадия, способная передаваться следующему хозяину), чаще атакуют позвоночных — потенциальных хозяев паразита (Koella et al., 1998; Koella et al., 2002; Cator et al., 2013; Smallegange et al., 2013; Cator et al., 2012), но при этом всасывают меньше крови за одну попытку (Koella et al., 2002).
Кроме того, объем крови, необходимый им для насыщения, больше, чем у незараженных комаров (Koella et al., 2002). Предполагается, что механизм манипулирования пищедобывательным поведением комара связан с локализацией плазмодия в слюнных железах хозяина, что позволяет паразиту контролировать выделение пищеварительных ферментов (Nyasembe et al., 2014). Интересно, что когда паразит еще не готов заразить следующего хозяина (стадия ооцисты), его влияние на поведение комара прямо противоположно— понижение пищедобывательной активности, уменьшение объема крови, необходимого для насыщения, и пр. (Koella et al., 2002). Вероятное объяснение этому — угроза жизни хозяина, а следовательно, и паразита, при питании кровью (Koella et al., 2002; Cator etal., 2012; Nyasembe etal., 2014). Пока паразит не готов заразить следующего хозяина, такой риск не в его интересах. Плазмодий даже меняет пищевые предпочтения хозяина, чтобы уменьшить вероятность его гибели в период созревания паразита. Комары р. Anopheles (окончательные хозяева плазмодия) способны питаться цветочным нектаром, хотя для успешного развития им все равно требуется кровь (Nyasembe et al., 2014). Пока паразит находится на стадии ооцисты (неинвазионная стадия), он заставляет хозяина поглощать больше нектара по сравнению с незараженными комарами, а после достижения паразитом зрелости (стадия спорозоита), напротив, — меньше (Nyasembe et al., 2014). Следует отметить, что, несмотря на обилие работ, подтверждающих способность малярийного плазмодия манипулировать поведением хозяина, существуют и исследования, не подтвердившие эту точку зрения (Vantaux et al., 2015). Кроме того, есть сомнения и том, что изменения в поведении хозяина специфически вызваны плазмодием, а не являются результатом неспецифического ответа иммунной системы хозяина на патоген (Cator et al., 2013). С другой стороны, вне зависимости от специфичности вызванных фенотипических изменений паразит может получать от этих изменений адаптивные преимущества. Напомним, что воздействие на фенотип хозяина опосредованно через иммунную систему, по всей видимости, один из распространенных механизмов паразитических манипуляций (Cezilly etal., 2014).
Малярийный плазмодий манипулирует и фенотипом промежуточного хозяина, делая его более привлекательной добычей для кровососущих насекомых (Emami et al., 2017). Так, зараженные малярией люди и птицы больше привлекали незараженных комаров р. Anopheles (Lacroux et al., 2005; Cornet et al., 2013). Причем комары предпочитали питаться кровью зараженных людей именно тогда, когда в их в крови присутствовали гамонты — инвазионные для комара стадии паразита (Lacroux et al., 2005). Одно из возможных объяснений этого феномена — адаптация насекомого (Cornet et al., 2013). Можно предположить, что зараженные малярией хозяева ослаблены и менее активны. Следовательно, они с меньшей вероятностью уничтожат кусающее их насекомое. Однако едва ли избирательное питание кровью зараженных малярией животных адаптивно для комара, поскольку заражение плазмодием (напомним, что в экспериментах использовали незараженных комаров) значительно понижает его приспособленность (плодовитость снижается примерно на 30%) (Cornet et al., 2013).
Другое не “манипулятивное” объяснение состоит в том, что увеличение привлекательности зараженных хозяев для переносчиков паразита — лишь побочный эффект инфекции. Скажем, покровы зараженного животного могут выделять больше углекислого газа, привлекая комаров. Однако скорее всего это ложный след (Cornet et al., 2013). Если побочные эффекты заболевания увеличивают вероятность передачи паразита следующему хозяину, то паразиты, способные усиливать и регулировать эти черты фенотипа хозяина, наверняка получали сильное адаптивное преимущество в ходе эволюции (Thomas et al., 2005; Cornet et al., 2013). He стоит забывать и о том, что зараженный малярией хозяин становится привлекательной добычей для комара именно в тот момент, когда плазмодий находится на подходящей для переноса жизненной стадии. Это говорит в пользу того, что в этой системе паразит—хозяин естественный отбор уже потрудился над совершенствованием и шлифовкой паразитической манипуляции.
Наконец, четвертую стратегию используют паразиты, передающиеся по трофической цепи. Эта весьма распространенная и, возможно, наиболее эффектная для стороннего наблюдателя стратегия так и называется — передача по трофической цепи, усиленная паразитом (parasite increased trophic transmission — PITT) (Lafferty, 1999). В тех случаях, когда паразит передается хищнику от его жертвы, ему оказывается выгодно так изменить фенотип своего хозяина, чтобы сделать его более привлекательным и удобным объектом для атаки следующего хозяина. Очень часто паразиты достигают этого, саботируя защитное поведение хозяина или сочетая поведенческие изменения с какими-то другими изменениями фенотипа хозяина, так называемое многомерное манипулирование (multidimensionality in manipulation) (Cezilly et al., 2013). Мы уже приводили несколько примеров подобных манипуляций. Ниже мы более подробно остановимся на нескольких хорошо изученных примерах PITT, обсудим возможность существования подобных манипуляций в сообществах живых существ, где далеко не все хищники, угрожающие хозяину, являются подходящими хозяевами для паразита.
Представители класса Acanthocephala (скребней), первичнополостных животных, родственных коловраткам,— облигатные паразиты. Промежуточными хозяевами им служат водные беспозвоночные (как правило, ракообразные), а дефинитивными — позвоночные (рыбы, птицы, млекопитающие). Яйца паразита, попадающие во внешнюю среду с фекалиями хозяина, поедаются промежуточными хозяевами, например, рачками-бокоплавами. В кишечнике бокоплава из яйца выходит просто организованная личинка — акантор. Акантор мигрирует в полость тела бокоплава, где после прохождения метаморфоза превращается в акантеллу, обладающую почти всеми чертами взрослого червя за исключением половой системы, которая остается недоразвитой. Позднее акантелла инцистируется, превращаясь в цистакант, и только после этого паразит становится инвазионнным, т.е. способным заразить следующего хозяина (Dianne et al., 2011).
Как минимум несколько видов скребней манипулируют поведением своих промежуточных хозяев. Ранее мы уже упоминали классические работы В. Ветла и Дж. Холмса, положившие начало исследованию паразитических манипуляций. Здесь мы хотим рассказать о Pomphorhynchus laevis, одном из наиболее изученных к настоящему моменту паразитов-манипуляторов (Cezilly et al., 2013). Р. laevis использует распространенный вид бокоплавов Gammarus pulex в качестве промежуточного хозяина и несколько видов пресноводных рыб в качестве окончательных хозяев. Поскольку рыбы охотно поедают бокоплавов в естественных условиях, гаммарусы выработали ряд приспособлений, позволяющих им избегать хищников. К таким приспособлениям относятся, например, покровительственная окраска, врожденная фотофобия (светобоязнь), использование убежищ, способность распознавать хищника по запаху и избегать его и т.п. (Bakker et al., 1997; Cezilly et al., 2013).
Благодаря этим приспособлениям, бокоплавы гораздо реже, чем хотелось бы паразитам, попадают в желудочно-кишечный тракт рыбы, где скребни могут завершить свой жизненный цикл. Паразит меняет фенотип хозяина с целью увеличить вероятность передачи инфекции окончательному хозяину. Зараженные Р. laevis бокоплавы перестают избегать освещенных участков (Bakker et al., 1997; Dianne et al., 2011) — их фотофобия сменяется фотофилией. Кроме того, зараженные бокоплавы активнее незараженных, что делает их заметнее для хищников (Cezilly et al., 2013). Более того, они реже используют убежища, а их реакция на кайромоны хищников сменяется с отрицательной на положительную — в тестах с бинарным выбором (в Y-образном лабиринте) зараженные рачки достоверно чаще оказывались в рукаве, куда поступала вода из аквариума с хищником, в то время как гаммарусы в контроле чаще выбирали рукав с чистой водой (Kaldonski et al., 2007). Наконец, скребни меняют и внешний облик G. pulex. Инвазионные стадии (цистаканты) Р. laevis имеют яркую желтооранжевую окраску и просвечивают сквозь кутикулу хозяина. Такие яркие пятна опять же делают бокоплава более заметными для хищника (Bakker et al., 1997). Влияет паразит и на многие другие черты фенотипа хозяина (Cezilly et al., 2013).
Здесь следует отметить несколько важных моментов. Во-первых, перечисленные выше изменения возникают тогда, когда паразиты достигают стадии цистаканта, т.е. становятся инвазионными для следующего хозяина (Dianne et al., 2011). Паразит словно ожидает момента, когда он окажется способен заразить следующего хозяина, и только потом запускает механизм манипуляции. Это хорошее свидетельство в пользу того, что мы имеем дело с “настоящей” манипуляцией, а не с побочным эффектом инфекции. Вообще, довольно долго совпадение по времени поведенческих изменений у хозяина с достижением паразитом инвазионности считалось непременным, хотя и не единственным, атрибутом доказанной манипуляции (Poulin, 1995). В каком-то смысле это справедливо и сейчас, однако, с некоторыми важными оговорками. Первое: неинвазионные (т.е. не готовые заразить следующего хозяина) паразиты вполне могут манипулировать поведением хозяев, но их манипуляции отличаются от манипуляций инвазионных паразитов. Они могут менять другие поведенческие черты хозяев или воздействовать на те же черты, но в противоположном направлении. Таким образом, правильнее сказать, что с достижением инвазионности паразиты переходят с одной модели манипулирования поведением хозяина на другую (Parker et al., 2009). Второе: даже если манипуляция возникает слишком рано в жизненном цикле паразита, это вовсе не значит, что она непременно не адаптивна.

Распределение серотонина (прокрашен зеленым) в мозге здорового (слева) и зомбированного (справа) скребнем (колючеголовым червем) бокоплава гаммаруса. olf и opt — обонятельные и зрительные участки соответственно. Стрелками показаны нейроны тритоцеребрума (заднего отдела головного мозга). Длина масштабной линейки 100 мкм. Рисунок из статьи: Simone Helluy. Parasite-induced alternations of sensorimotor pathways in gammarids: collateral damage of neuroinflammation? в The Journal of Experimental Biology
Представим себе ситуацию, когда вероятность встречи хозяина с хищником (следующим хозяином) очень мала. Пусть в нашей воображаемой системе паразит-хозяин манипуляция поведением хозяина, делающая его более уязвимым перед хищником, возникает слишком рано, когда паразит еще не достиг инвазионной стадии. Тогда на протяжении относительно короткого периода до “созревания” паразит действительно будет рисковать —гибель хозяина приведет и к его гибели, но риск этот будет не слишком велик, поскольку по определению для нашей системы встреча хозяина с хищником — событие маловероятное. После достижения паразитом инвазионности манипуляция будет увеличивать его приспособленность, повышая вероятность попадания в организм следующего хозяина. Положительные для паразита стороны манипуляции вполне могут в конечном итоге перевесить риски и сделать манипуляцию адаптивной. А в дальнейшем естественный отбор будет благоприятствовать тому, чтобы момент достижения паразитом инвазионности точнее совпадал с возникновением поведенческих изменений у хозяина.
Но вернемся к системе Р. laevis — G. pulex. Второй важный момент —для этой системы не только обнаружено влияние паразита на защитные адаптации хозяина, но и показано, что эти поведенческие изменения действительно делают гаммаруса более подходящей добычей для окончательного хозяина паразита —рыбы (Bakker et al., 1997; Kaldonski et al., 2009; Dianne et al., 2011). Такая проверка, пожалуй, лучшее подтверждение адаптивности поведенческих изменений, вызванных паразитом, хотя для многих систем паразит — хозяин осуществить такую проверку сложно технически (Moore, 2013).
Третий момент — многомерность манипуляции Р. laevis. Под многомерными фенотипическими изменениями, вызванными паразитом (multidimensionality in parasite-induced phenotypic alterations) подразумевают способность паразита влиять одновременно на несколько (иногда много как в случае с Р. laevis) независимых фенотипических черт хозяина (Cezilly et al., 2013). Влияние это не обязательно связано с манипуляциями, но мы в дальнейшем будем писать только о тех фенотипических чертах хозяина, изменение которых увеличивает приспособленность паразита, и использовать выражение — многомерные манипуляции. Так, Баккер с соавт. (Bakkeret al., 1997) обнаружили, что хотя Р. laevis воздействует и на защитную окраску, и на поведение бокоплава, любого из этих воздействий по отдельности достаточно для того, чтобы сделать хозяина более уязвимым для хищника— трехиглой колюшки (Gasterosteus aculeatus). Зачем же тогда манипулировать несколькими чертами фенотипа хозяина одновременно?
Адаптивность многомерных манипуляций может быть связана с тем, что у паразита может быть несколько подходящих следующих хозяев (Cezilly et al., 2013). И каждая измененная защитная черта делает хозяина паразита (скажем, гаммаруса) более заметным для одного из следующих хозяев. Другое объяснение — фенотипические изменения могут производить кумулятивный эффект или даже усиливать эффект друг друга. В первом случае паразит манипулирует несколькими чертами фенотипа хозяина просто потому, что две черты лучше, чем одна, три лучше, чем две и т.д. (Cezilly et al., 2013). Во втором случае взаимодействие двух манипуляций фенотипом хозяина усиливает эффект каждой из них взятой в отдельности.
Например, нарушение покровительственной окраски само по себе не столь критично и может быть компенсировано использованием убежищ или низкой двигательной активностью хозяина. Однако быть одновременно активным и скрытным трудно (Lima, Dill, 1990), и если вдобавок к бросающейся в глаза хищнику окраске паразит сумеет сделать хозяина более активным или уменьшить время его пребывания в убежище, то хозяин практически обречен на заклание. Это отчасти напоминает принцип двух слабостей в эндшпиле шахматной партии, когда позиция с одной слабостью легко удерживается, в то время как вторая слабость делает ее практически незащитимой (Шерешевский, 1988). Наконец, еще одна возможность—манипуляции поведением хозяина могут служить разным целям. Часть поведенческих изменений делает хозяина более уязвимым для подходящего хищника (т.е. хищника, способного быть следующим хозяином паразита), в то время как другие эффекты манипуляции, напротив, уменьшают шансы хозяина стать жертвой неподходящего хищника (Cezilly etal., 2013). Подробнее эта возможность будет обсуждаться ниже. Остается заметить, что следует с осторожностью относиться к “независимости” фенотипических черт, которыми манипулирует паразит. Так, по крайней мере некоторые параллельные фенотипические изменения, вызываемые скребнями Р. laevis, можно индуцировать искусственно инъекцией серотонина бокоплаву (Perrot-Minnot et al., 2014).
Стоит отметить и четвертую любопытную деталь, характеризующую систему Р. laevis — G. pulex, обнаруженные в ней манипуляции аналогичны манипуляциям в других системах паразит — хозяин. Это не самое важное, но тем не менее ценное свидетельство адаптивности обнаруженных изменений в поведении гаммарусов. Если какие-то фенотипические черты возникли в нескольких эволюционных линиях животных независимо, то это хорошее свидетельство в пользу их адаптивности (Poulin, 1995). Скажем, способность нарушать покровительственную окраску хозяина многократно и независимо возникала у скребней, трематод и цестод (Bakker et al., 1997; Seppala et al., 2005; Lagrue et al., 2016). Причем даже в пределах одной группы механизмы, вызывающие сходные фенотипические изменения, могут варьировать. Так, если Р. laevis демаскирует хозяина, накапливая в своем организме каротиноиды, благодаря которым оранжевые цистаканты просвечивают сквозь серо-зеленую кутикулу хозяина, то другой скребень (Plagiorhynchus allisonae) каким-то образом воздействует на окраску самого хозяина (морская амфипода Transorchestia chiliensis), заставляя его кутикулу приобретать необычные оттенки (Lagrue et al., 2016).
Приведем еще два примера РIТТ. Первый — манипуляции трематод Euhaplorchis sp. поведением небольшой карпозубообразной рыбки Fundulus parvipinnis (LafFerty, Morris, 1996) —позволит нам перекинуть “мостик” к дальнейшему разговору о роли паразитов в экосистемах. Ученые из Калифорнии Лафферти и Моррис обратили внимание, что некоторые рыбки, в остальном вполне нормальные, совершали странные действия, делающие их хорошо заметными в водоеме и выделяющие их среди собратьев (LafFerty, Morris, 1996). Они подергивались, “бликовали” в лучах солнца, слегка вибрировали в воде, совершали резкие беспричинные рывки к поверхности и т.п. (LafFerty, Morris, 1996). Исследователи предположили, что причиной этих поведенческих особенностей могут быть трематоды Euhaplorchis californiensis, локализующиеся в мозге рыб. Окончательными хозяевами этих трематод служат разные виды рыбоядных птиц, и паразиту выгодно сделать своих хозяев более заметной, а значит и более доступной добычей для обитателей воздушной среды (LafFerty, Morris, 1996).
Поведенческие эксперименты показали, что зараженные трематодой рыбки действительно достоверно чаще демаскируют себя по сравнению с незараженными (Lafferty, Morris, 1996). К. Лафферти и А. Моррис, однако, решили не останавливаться на этом и выяснить, насколько заражение рыбки трематодой Е. californiensis повышает риск быть пойманной рыбоядной птицей. Оказалось, что зараженных рыбок птицы поедали намного чаще, чем незараженных. При этом не было оснований считать, что паразит каким-то радикальным образом ухудшает физическое состояние рыбы (Lafferty, Morris, 1996; Lafferty, 2008). Учитывая уровень естественной смертности и изменение соотношения между зараженными и незараженными рыбами в ходе эксперимента, было подсчитано (Lafferty, Morris, 1996), что паразит увеличивает шансы рыбки быть съеденной более чем в тридцать раз! Позднее было показано, что важную роль в инициации поведенческих изменений может играть изменение уровней дофамина и серотонина в ЦНС F parvipinnis (Shaw et al., 2009).
Исследование К. Лафферти и А. Морриса показывает, какую важную роль могут играть паразитические манипуляции в регуляции взаимоотношений хищников и их жертв.
Toxoplasma gondii: один паразит — две стратегии манипуляции
Последний пример паразитических манипуляций, который мы хотим привести, имеет прямое отношение не только к сообществам животных в дикой природе, но и к человеческому обществу (Lafferty, 2006). Речь, разумеется, идет о токсоплазме (Toxoplasma gondii), паразитическом простейшем, образующем цисты в мышцах и мозге теплокровных животных и влияющем на поведение грызунов и человека (Berdoy et al., 2000; McConkey et al., 2013; Flegr, 2015). Дефинитивным хозяином токсоплазмы выступают кошки, в кишечнике которых проходит процесс полового размножения паразита и формирования ооцист (Vyas et al., 2007; Flegr et al., 2014a, b). Кошки заражаются паразитом, поедая плоть зараженных токсоплазмой животных. Промежуточным хозяином простейшему служат многие теплокровные животные, включая человека. Промежуточные хозяева заражаются, проглатывая либо ооцисты токсоплазмы (содержатся в фекалиях кошек), либо тканевые цисты в мясе зараженных животных (Vyas et al., 2007; Flegr et al., 2014a, b). Кроме того, есть серьезные основания полагать, что токсоплазма передается половым путем, поскольку тахизоиты, подвижные расселительные стадии паразита, содержатся в семенной жидкости зараженных самцов многих животных, включая человека (Flegr et al., 2014а).
После короткой острой фазы инфекции токсоплазмоз переходит в хроническую стадию, практически не имеющую клинических проявлений (Flegr, 2015). Выяснилось, однако, несмотря на кажущуюся безобидность, токсоплазма меняет поведение своих хозяев, причем эти изменения могут иметь достаточно серьезные последствия. Первые сведения о манипуляциях Т. gondii поведением хозяина появились еще в 70-е годы прошлого века (Flegr, 2015). Вначале на мышах, а потом на крысах было показано, что зараженные животные более активны по сравнению с контрольными, обладают повышенным интересом к незнакомым объектам, несколько хуже обучаемы, более агрессивны и т.п. (Flegr, 2015). Но, пожалуй, самое эффектное поведенческое изменение, вызываемое токсоплазмой, это так называемое роковое влечение (fatal attraction) зараженных грызунов к местам, где недавно побывала кошка (Berdoy, 2000; Flegr, 2015; Heil, 2016). Дело в том, что в норме грызуны обладают врожденной способностью избегать таких мест (Berdoy et al., 2000; Vyas et al., 2007).
Токсоплазма подавляет эту способность и даже, напротив, делает запах кошки (например, кошачьей мочи или полотенца, которым потерли кошку) привлекательным для хозяина (Berdoy et al., 2000; Vyas et al., 2007). Другими словами, паразит производит тончайшие изменения в мозге грызуна, увеличивая его шансы быть съеденным следующим хозяином, при этом не нанося заметного вреда здоровью хозяина в целом (Berdoy et al., 2000). Стоит, однако, заметить, что прямая проверка гипотезы PITT, т.е. эксперименты, где тестировалась бы способность зараженных и незараженных грызунов избегать кошки, по всей видимости, никогда не проводилась.
Зато экспериментально проверялось предположение, что зараженные токсоплазмой самцы крыс более привлекательные половые партнеры для незараженных токсоплазмой самок. Напомним, что у многих животных токсоплазма способна передаваться половым путем (Flegr et al., 2014а). Как правило, животные (и крысы здесь не исключение) стараются избегать половых партнеров, зараженных паразитами. Большинство общепринятых гипотез сходятся на том, что именно избегание инфекции является важнейшей движущей силой полового отбора (Hamilton, Zuk, 1982; Vyas, 2013), а возможно, и причиной, по которой вообще появился половой процесс (Hamilton et al., 1990). У многих видов выраженность вторичных половых признаков у особи коррелирует с ее устойчивостью к инфекциям (Milinski, Bakker, 1990).
Скажем, самки трехиглых колюшек предпочитают спариваться с самцами с более яркой окраской (Milinski, Bakker, 1990). При этом яркая окраска у самцов свидетельствовала об их устойчивости к паразитам (Milinski,1990). Кроме того, Гамильтон и Зук в своей классической работе (Hamilton, Zuk, 1982) показали, что у видов, сталкивающихся с более сильным давлением паразитов, эпигамные признаки выражены сильнее. Да и в прямых поведенческих тестах было показано, что при выборе стайки животные стараются избегать зараженных особей.
[далеко не всегда; в ряде случаев наоборот, последние делаются лидерами стайки, если их достаточно много, т.ч. поведение, предпочтительное для паразита, появляется и у незаражённых особей уже не из-за инфицирования, а действием социальных механизмов. Прим.публикатора]
Однако токсоплазма влияет на привлекательность своего хозяина для особей другого пола противоположным образом. Незараженных самок крыс больше привлекают зараженные токсоплазмой самцы (Dass et al., 2011; Vyas, 2013). По всей видимости, это связано с тем, что паразиты увеличивают выработку тестостерона в их семенниках, а это в свою очередь может усиливать проявления фенотипических признаков, привлекающих самку. Любопытно, что на человека токсоплазма влияет сходным образом (Flegret al., 2008), однако, насколько нам известно, гипотеза о большей сексуальной привлекательности зараженных мужчин никогда целенаправленно не проверялась.
Токсоплазма — это уникальный паразит, совмещающий как минимум две манипулятивные стратегии: Р1ТТ для вертикального переноса между промежуточным и окончательным хозяином и увеличение сексуальной привлекательности хозяина для переноса половым путем между представителями своего вида (Vyas, 2013). Возможно, однако, что за обе разновидности манипуляции отвечает один и тот же механизм —влияние паразита на синтез дофамина в мозге хозяина (McConkey et al., 2013). Действительно, повышение концентрации дофамина в определенных участках ЦНС приводит и к ослаблению чувства опасности и к повышению либидо у животных (Baskerville, Douglas, 2010). Это может объяснить и такой феномен, как различное, а подчас и противоположное влияние токсоплазмы на поведение самцов и самок (Flegr, 2015).
С другой стороны, манипуляции токсоплазмы многомерны, и далеко не все поведенческие изменения могут быть объяснены влиянием дофамина. Эксперименты же не всегда безусловно поддерживают дофаминовую гипотезу (Vyas, 2015). Поэтому лишь дополнительные исследования смогут окончательно подтвердить или опровергнуть ее корректность. Еще один кандидат на роль ключевого вещества в манипуляциях токсоплазмы—тестостерон (Vyas, 2013). Здесь, впрочем, тоже пока все ограничивается интересными спекуляциями.
Манипуляции токсоплазмы имеют непосредственное отношение и к человеческой популяции. Разумеется, современные люди редко становятся добычей кошек, хотя, возможно, еще в недавнем эволюционном прошлом это было вполне возможно. Скажем, наши ближайшие родственники, шимпанзе, перестают воспринимать запах мочи леопарда как угрожающий стимул, если они заражены токсоплазмой (Poirotte et al., 2016). Впрочем, мы в любом случае разделяем с другими позвоночным множество различных физиологических черт, а манипуляции токсоплазмы не очень специфичны. Поэтому неудивительно, что этот паразит воздействует на поведение человека, как и на поведение других видов животных (Lafferty, 2006; Flegr, 2015).
Вопросу влияния токсоплазмы на человеческий фенотип посвящена обширная литература, тщательно анализировать которую в этой работе нет ни возможности, ни необходимости. Поэтому мы ограничимся кратким резюме современного состояния дел в этом вопросе. Прежде всего отметим, что непосредственные эксперименты над людьми невозможны по понятным этическим причинам, поэтому оценка человеческого поведения и личностных черт чаще всего производится с помощью опросников, используемых психологами и социологами (Flegret al., 2000). Следовательно, к любым аналогиям между поведенческими изменениями, вызванными токсоплазмой у человека и других животных, нужно относиться с некоторой осторожностью. Тем не менее в настоящий момент скорее принято признавать аналогии между изменениями поведения человека и других животных под воздействием токсоплазмы.
Например, ослабление концентрации внимания и некоторое замедление реакции у зараженных токсоплазмой людей вкупе с личностными изменениями приводит, вероятно, к пониженному чувству опасности (Flegr, 2014а; 2015). А противоположное влияние токсоплазмы на некоторые фенотипические черты у мужчин и женщин (Ней, 2016) намекает на манипуляции токсоплазмы с целью увеличить передачу инфекции половым путем. Скажем, Лафферти предположил, что у мужчин личностные изменения (невротизм), вызванные токсоплазмой, приводят к большей маскулинности (напомним и про повышенный уровень тестостерона) (Lafferty, 2006). Трудно сказать, как обстоят дела в современном человеческом обществе, но рискнем предположить, что еще в недавнем эволюционном прошлом нашего вида повышенный уровень тестостерона и выраженность вторичных половых признаков у самцов повышали вероятность их половых контактов с самками.
Как всегда без проведения контролируемых экспериментов трудно однозначно утверждать, что именно паразит является причиной поведенческих изменений у хозяина, а не поведенческие черты хозяина приводят к большей вероятности заражения паразитами. Однако косвенные доказательства свидетельствуют, что в системе Homo sapiens — Toxoplasma gondii реализуется именно первый сценарий. Так, выраженность поведенческих изменений положительно коррелирует с продолжительностью латентной стадии инфекции, т.е. чем дольше человек заражен токсоплазмой, тем больше меняется его фенотип (Flegr et al., 2000).
По существующим оценкам токсоплазма — самая распространенная инфекция в человеческой популяции. Примерно 30—50% от общей численности нашего вида инфицировано токсоплазмой, причем в некоторых популяциях доля зараженных может быть близка к 100% (Flegr et al., 2014b; Flegr, 2015). Фенотипические изменения, вызванные токсоплазмой, малозаметны, но могут иметь весьма негативные последствия. Так, токсоплазма увеличивает предрасположенность зараженных людей к нервным и психическим расстройствам (шизофрения, болезнь Паркинсона). Замедленная реакция и ослабленное чувство опасности приводят к тому же, что зараженные токсоплазмой индивиды больше подвержены травматизму во время профессиональной деятельности и чаще попадают в дорожно-транспортные происшествия (Flegr, 2015; Heil, 2016). Статистические эффекты подобного влияния токсоплазмы обычно слабые, но достоверные, и, учитывая распространенность паразита в популяции, пренебрегать ими нельзя. Наконец, существует предположение, что токсоплазма способна довольно заметно влиять на человеческую культуру и общество в целом (Lafferty, 2006).
Например, в странах Запада доля зараженных особей в популяции токсоплазмой положительно коррелирует с такой важной культурной особенностью общества как избегание неопределенности (ИН) в социальных отношениях (uncertainty avoidance). Под ИН понимают стремление людей в обществе максимально регламентировать социальные взаимодействия, т.е. такие общества в целом характеризуются развитыми правовыми отношениями и уважением к законодательным нормам. Стоит отметить, что зараженность токсоплазмой объясняет лишь 15% вариации в ИН, т.е. сила связи довольно слабая, а уровень значимости статистического теста невысок (Lafferty, 2006). Кроме того, корреляция не подразумевает причинности. Тем не менее тот факт, что различия в общественном устройстве могут быть объяснены паразитическими манипуляциями, заслуживает пристального внимания и дальнейшего изучения.
Экспериментальные полевые исследования манипуляций
И последнее. В первых работах (70-е годы XX века), посвященных паразитическим манипуляциям, как правило, использовались организмы, заразившиеся паразитами в естественных условиях, а затем собранные из природных источников и акклимированные в лаборатории для дальнейших экспериментов. Это создавало некоторую двусмысленность в трактовке дальнейших результатов экспериментов. Фенотипические различия между зараженными и незараженными животными могли быть как следствием воздействия паразитов, так и причиной заражения ими (Poulin, Maure, 2015). Скажем, большая активность зараженных скребнями амфипод может быть как приспособлением паразита, так и чертой хозяина, делающей его более предрасположенным к заражению паразитами. Поэтому важно проводить поведенческие тесты на животных, экспериментально зараженных в лабораторных условиях. В конце XX века доля исследований, проведенных на экспериментально зараженных хозяевах, неуклонно росла, достигнув в 1990-е годы примерно половины от общего числа работ по теме (Poulin, Maure, 2015). Например, эксперименты в системах скребни — бокоплавы, изначально проведенные на заразившихся в естественной среде рачках, затем были подтверждены в контролируемых лабораторных условиях. Тем удивительнее, что, несмотря на заметный рост интереса исследователей к паразитическим манипуляциям, в последние пятнадцать лет доля исследований, проведенных на экспериментально зараженных хозяевах, значительно уменьшилась (Poulin, Maure, 2015).
В какой момент паразит должен начать манипулировать своим хозяином? Специфичность манипуляции
Представим себе паразита только что заразившего промежуточного хозяина. Допустим, что для завершения жизненного цикла ему нужно оказаться в организме хищника. В какой момент паразит должен приступать к изменению поведения промежуточного хозяина, чтобы сделать его более доступной добычей для окончательного? Едва ли он должен делать это немедленно после заражения. Теоретически это, наверное, возможно, но в природе паразиту, как правило, требуется некоторое время, чтобы достигнуть инвазионности (“зрелости”), т.е. стадии, когда он готов заразить следующего хозяина. Пока паразит неинвазионен, смерть хозяина неизбежно повлечет за собой и смерть паразита (Parker et al., 2009). Таким образом, обычно паразиту выгодно подавлять защитное поведение хозяина (усиление хищничества — predation enhancement — в англоязычной литературе) только после достижения паразитом “зрелости”. Действительно, если поведение хозяина меняется в сторону меньшей осторожности одновременно с достижением паразитом инвазионнной стадии, то это веский довод в пользу того, что мы имеем дело с “настоящей” манипуляцией (Poulin, 1995). Другое дело, что неинвазионные паразиты тоже могут манипулировать поведением своих хозяев, но несколько иначе (см. ниже).
Еще один естественно возникающий вопрос, насколько специфичной должна быть манипуляция? Ведь в природе далеко не все хищники могут быть подходящими хозяевами для паразита. Если промежуточный хозяин окажется жертвой такого неподходящего “тупикового” хищника (dead-end predator), то завершить жизненный цикл у него не получится (Seppala et al., 2008). Так имеет ли смысл вообще делать хозяина более доступной добычей, если в среде есть неподходящие хищники? Должна ли манипуляция быть специфичной, т.е. должен ли хозяин становиться менее защищенным от атак подходящего хозяина паразита, но при этом его шансы стать жертвой “тупикового” хищника не должны возрастать? Эти вопросы достаточно подробно рассматривались специалистами по математическому моделированию (Seppala, Jokela, 2008; Parker et al., 2009) и однозначного ответа на них не существует. В некоторых ситуациях неспецифическая манипуляция может быть адаптивна (Seppala, Jokela, 2008; Parker et al., 2009).
Представим себе, что для хозяина риск стать жертвой хищника изначально очень мал. Например, в силу того, что хищник редок, или из-за того, что после достижения паразитом зрелости хозяин быстро умирает от не связанных с хищничеством причин (Parker et al., 2009). Тогда неспецифическая манипуляция оказывается адаптивной. Если же изначальный риск хищничества достаточно велик, то адаптивной оказывается только специфическая манипуляция (Parker et al., 2009). Паркер с соавт. предположили, что манипуляция имеет больше шансов возникнуть в ходе эволюции, если она специфична (Parker et al., 2009). Впрочем, нельзя сказать, что существующие эмпирические данные безусловно поддерживают это предположение.
Экспериментальные и полевые исследования действительно подтверждают, что паразитические манипуляции увеличивают шансы хозяина стать как жертвой подходящего хищника, так и “тупикового” (Parker et al., 2009). А вот примеры по-настоящему специфических манипуляций пока единичны. Так, в полевых исследования, проведенных на рачках G. pulex, получено косвенное подтверждение того, что хотя зараженные паразитами (скребнями Р. laevis) особи чаще оказываются жертвой подходящего хищника (карповой рыбы) по сравнению с незараженными, их шансы сделаться добычей “тупикового” хищника (лягушки) ничуть не выше (Lagrue et al., 2007). Позднее эксперименты, проведенные на другой системе бокоплав — скребень (G. roeseli — Polymorphus minutus), показали, что зараженные рачки достоверно реже становились добычей неподходящего с точки зрения паразита хищника — колюшки (окончательным хозяином Р. minutus является рыбоядная птица) (Medoc et al., 2009; Medoc, Beisel, 2011). Этот результат тем более интересен, что скребни р. Polymorphus изначально были известны своей способностью менять поведение хозяина в сторону меньшей осторожности и делать своего хозяина более доступной добычей для окончательного хозяина — птицы (Bethel, Holmes, 1977).
Таким образом, здесь мы, возможно, имеем дело с уникальной (пока?) системой, где паразит, с одной стороны, увеличивает шансы хозяина стать добычей следующего хозяина, а с другой — “защищает” своего хозяина от “тупикового” хищника. Следует, однако, оговориться, что упомянутые выше исследования проводились на двух разных, хотя и близкородственных видах скребней Р. minutus и Р. paradoxus (Medoc et al., 2009 и Bethel, Holmes, 1977 соответственно). Тем не менее работ, подтверждающих специфичность манипуляций, мало. Одно из возможных объяснений — трудоемкость подобного рода исследований. В них задействовано сразу много объектов: паразит, хозяин, подходящий и “тупиковый” хищники. Соблюсти реалистичные, т.е. похожие на естественные, условия в контролируемом эксперименте с таким числом слагаемых довольно проблематично.
III. “Неклассическая” манипуляция. Конфликты, кооперация и эусоциальность у паразитов
Манипуляции неинвазионных паразитов
Bodyguard manipulation. На протяжении долгого времени манипуляции считались прерогативой инвазионных паразитов, т.е. паразитов, уже способных заразить следующего хозяина (Poulin, 1995). Предполагалось, что манипуляция возникает только тогда, когда паразит достигает инвазионности. Скажем, для гетероксенного паразита, меняющего в течение жизни нескольких хозяев, необходимым условием передачи своих генов является попадание в окончательного хозяина, в организме которого паразит размножается половым путем. Часто, хотя и далеко не всегда, этот хозяин должен просто съесть предыдущего, гарантированно приобретая паразита. Следовательно, цель манипулирования для такого паразита — повысить шансы промежуточного хозяина встретиться со следующим хозяином, скажем, сделать его более заметным для хищника или изменить его место обитания. Однако все это справедливо только для инвазионного паразита. В последнее десятилетие исследователей все больше стали интересовать манипуляции паразитов неинвазионных. Для неинвазионного паразита хозяин представляет собой ценный ресурс, который может быть использован в будущем. Гибель хозяина окажется и гибелью для паразита. Поэтому цель такого паразита — продлить жизнь хозяина до того момента, когда он достигнет инвазионной стадии (Parker et al., 2009; Hafer, Milinski, 2015; Gopko et al., 2015).
Один из способов сохранить жизнь своему хозяину — изменить его поведение в сторону большей осторожности (подавления хищничества—predation suppression — в англоязычной литературе), и только потом, когда паразит будет готов заразить следующего хозяина, при необходимости поменять его поведение в противоположном направлении (predation enhancement) (Parker et al., 2009).
Довольно быстро выяснилось, что паразиты действительно способны менять поведение своих хозяев в сторону большей осторожности, причем подобные манипуляции едва ли являются чем-то уникальным. Во всяком случае, они были обнаружены в нескольких весьма непохожих друг на друга системах паразит — хозяин: скребни — гаммарусы (Dianne et al., 2011); ленточные черви/нематоды — копеподы (Hammerschidt et al., 2009; Weinreich et al., 2012); трематоды — рыбы (Gopko et al., 2015; Гопко и др., 2014) и пр. Для трех из этих систем было напрямую показано, как по мере “созревания” паразиты переходят от усиления защитного поведения хозяина к его подавлению. Более того, в одном случае усиление/подавление защитного поведения было подтверждено в прямых экспериментах с хищником (Dianne et al., 2011).
Теоретическая модель предполагает, что манипуляции неинвазионных паразитов (подавление защитного поведения хозяина) должны быть достаточно широко распространены в природе, поскольку с эволюционной точки зрения таким манипуляциям проще сформироваться (Parker et al., 2009). Условие специфичности манипуляции для них не обязательно ни при каких обстоятельствах, хотя и возможно. Для неинвазионного паразита подходящих хищников не бывает и ему, в отличие от инвазионного паразита, нет необходимости одновременно решать две противоположные задачи — избегать “тупиковых” хозяев и привлекать подходящих (Parker et al., 2009). Тем не менее в научной литературе не так много данных о манипуляциях неинвазионных паразитов.
Самое простое объяснение этому — относительная новизна темы. По большому счету, целенаправленно манипуляции неинвазионных паразитов начали исследовать не более 10 лет назад (Parker et al., 2009; Hammerschmidt et al., 2009; Koella et al., 2002; Shirakashi, Goater, 2005). Другая возможная причина-манипуляции неинвазионных паразитов мало заметны человеческому взгляду (Parker et al., 2009). Действительно, манипуляции “зрелых” паразитов часто вызывают хорошо заметные фенотипические изменения — появление ярких пятен, привлекающих хищника, неосторожное или откровенно суицидальное поведение. Такие изменения могут быть легко замечены в природе и потом подтверждены в ходе лабораторных экспериментов. Неинвазионные паразиты не дают исследователю таких подсказок. Они должны увеличивать осторожность и скрытность хозяина, а осторожность и скрытность не слишком заметны для стороннего наблюдателя.
Третье возможное объяснение того, что данных о манипуляциях неинвазионных паразитов мало, связано с тем, что паразитическая манипуляция, как и любая другая адаптация (Докинз, 2010, с. 91), процесс затратный (Poulin, 1994; Poulin et al., 2005). Каким бы ни был механизм манипуляции, она наверняка требует от паразита вкладывать в нее некоторое количество вещества и энергии (например, чтобы синтезировать молекулы, воздействующие на нервную систему хозяина). Паразит, достигший инвазионной стадии, обычно прекращает свой рост (GALM — growth arrest at larval maturity) (Parker et al., 2015), в то время как неинвазионный паразит тратит много энергии на собственный рост и развитие. Возможно, в некоторых случаях такому паразиту предпочтительнее вкладывать все ресурсы в скорейший рост, жертвуя такой возможностью, как манипуляция поведением хозяина.
Возникает еще один естественный вопрос: как незараженные паразитом особи могут быть менее осторожны по сравнению с зараженными неинвазионными паразитами? Разве животное не пытается максимизировать свои защитные возможности? По всей видимости, нет. Дело в том, что, несмотря на всю свою важность, защита от хищника — не самоцель. Помимо обеспечения собственной безопасности в долгосрочной перспективе, животное должно питаться, бороться за территорию, спариваться и делать массу других вещей, необходимых для успешной передачи своих генов в следующее поколение. И естественный отбор поддерживает распределение времени и ресурсов на все эти разнообразные типы поведения, близкое к оптимальному (Parker et al., 2009; Gopko et al., 2015).
Паразита не интересуют эти долгосрочные и чуждые ему планы — его интересует только собственное воспроизведение и, как правило, он не задерживается в организме промежуточного хозяина надолго. Поэтому он способен смещать распределение времени и ресурсов хозяина от оптимального в сторону гипертрофированного защитного поведения (Parker et al., 2009; Gopko et al., 2015).
Наконец, стоит отметить еще один тип манипуляций, в сущности, очень похожий на манипуляции неинвазионных паразитов. Это уже упомянутые выше bodyguard manipulations, когда паразит заставляет хозяина играть роль своего телохранителя (Maure et al., 2013). Так поступают многие паразиты-наездники, хозяева которых плетут защитные коконы для не способной постоять за себя личинки паразита или даже прикрывают ее своим телом от нападений хищников. В этом случае паразиты (паразитоиды) стремятся не достигнуть инвазионной стадии, а пройти процесс метаморфоза и превратиться в имаго. Кроме того, паразитоид к этому моменту находится не внутри тела хозяина, а вне его, и соответственно манипуляция заключается не в том, что хозяин становится более осторожным, а в том, что он непосредственно защищает манипулятора. Еще находясь в внутри хозяина, личинка наездника, вероятнее всего, химически воздействует на его организм так, чтобы потом, в течение некоторого времени, иногда это продолжается неделю и больше, хозяин вел себя так, как требуется паразиту (Maure et al., 2011, 2013).
Конфликты и кооперация между паразитами одного вида: затраты на манипуляцию
Сразу оговоримся, что в этом обзоре мы не затрагиваем такой важной и захватывающей темы, как межвидовые взаимоотношения паразитов в организме хозяина. Возможные взаимодействия подобного рода разнообразны и заслуживают отдельной статьи. Желающим ближе познакомиться с этой интереснейшей темой рекомендуем посмотреть следующие обзоры (Сох, 2001; Thomas et al., 2005; Cezilly et al., 2014) и ссылки в них. Здесь же мы остановимся на внутривидовых конфликтах и внутривидовой кооперации у паразитов, манипулирующих поведением хозяина.
Возможность внутривидового конфликта возникает из простого наблюдения, что инвазионные и неинвазионные паразиты преследуют своей манипуляцией разные цели и зачастую пытаются изменить поведение хозяина в противоположных направлениях (Hafer, Milinski, 2015). Так, инвазионные паразиты стараются ослабить защитное поведение хозяина, неинвазионные напротив усилить его. Если хозяин заражен одновременно и “зрелыми” и “незрелыми” паразитами, то возникает конфликт, для которого возможны, как минимум, три логичных исхода. Это либо полная победа одной из сторон конфликта — фенотип хозяина, зараженного паразитами разных возрастов, соответствует фенотипу хозяина, зараженного только инвазионным или неинвазионным паразитом, либо некий компромисс, когда изменения поведенческих черт, вызванных “зрелыми” и “незрелыми” паразитами, компенсируют друг друга.
Интуитивно наиболее вероятным кажется третий вариант, а теоретические предпосылки говорят в пользу того, что более эффективной окажется манипуляция неинвазионного паразита (Parker et al., 2009). Однако экспериментальные данные свидетельствуют скорее о превосходстве инвазионных паразитов в подобных конфликтах. Так, Хафер и Милински (Hafer, Milinski, 2015) изучали внутривидовой конфликт у ленточных червей Schistocephalus solidus, промежуточным хозяином которым служили копеподы Macrocyclops albidus. И инвазионные, и неинвазионные черви манипулируют поведением своих хозяев (активностью после имитации атаки хищника), но в разных направлениях. Неинвазионные паразиты снижают активность хозяина и соответственно риск быть съеденным, а инвазионные, напротив, активность увеличивают. Когда же копепод заражали паразитами разного возраста, их активность была сходна с активностью рачков, зараженных только инвазионными паразитами. Аналогичные результаты были получены и в системе скребень — изопода (Sparkes et al., 2004).
И только в одной работе (Dianne et al., 2011), где авторы изучали скребней Р. laevis, паразитирующих в рачках G. pulex, авторы обнаружили у зараженных паразитами разного возраста особей промежуточный фенотип, свидетельствующий о “компромиссе” между паразитами. Впрочем, работы, посвященные конфликтам между паразитами одного вида (но разного возраста), пока единичны, и нужны дополнительные эмпирические данные и последующий мета-анализ для того, чтобы оценить, какая из сторон чаще получает преимущество в таких конфликтах.
Кооперация между манипулирующими паразитами может проявляться в разнообразных формах. Простейший пример: два паразита способны сильнее изменить поведение хозяина, чем один. Это может привести к тому, что оба паразита увеличат свои шансы попасть в организм следующего хозяина. Другой пример — гибель одной особи в инфрапопуляции паразитов ради успешной манипуляции и передачи других особей по трофической цепи, как это происходит у трематоды Dicrocoelium dendriticum и родственных ей видов (Poulin et al., 2005). В данном случае кооперация скорее всего следствие кин-отбора (Докинз, 2010, с. 369; Poulin et al., 2005). Однако второй пример довольно экзотический, а первый совсем тривиальный. Кроме того, далеко не всегда степень изменений фенотипа хозяина положительно коррелирует с интенсивностью заражения хозяина, и это логично, поскольку паразит вовсе не обязательно должен стремиться максимизировать отклонения от нормального фенотипа. Скажем, трематода, заинтересованная в том, чтобы раковина улитки, в которой она паразитирует, утолщалась, обеспечивая червю дополнительную защиту, едва ли стремится сделать эту раковину бесконечно толстой. Скорее всего существует некоторая оптимальная для паразита толщина раковины, хотя и превышающая оптимальную толщину раковины с точки зрения хозяина, но все-таки конечная (Докинз, 2010, гл. 12). Другими словами, паразит не максимизирует, а оптимизирует фенотипические изменения у хозяина (Vyas et al., 2007). Следовательно, вклад энергии, необходимый для достижения такого оптимума, тоже имеет предел, а не растет бесконечно (Vyas et al., 2007). Это приводит нас к следующей форме кооперации между паразитами одного вида— разделению затрат.
Однако прежде чем говорить о кооперации между паразитами одного вида, необходимо чуть подробнее остановиться на таком понятии, как затраты на манипуляции (cost of manipulation или manipulation effort) (Poulin, 1994; Poulin et al., 2005; Gopko et al., 2017b). Как и любая адаптация, манипуляция поведением хозяина требует определенных затрат вещества и энергии. Например, производство нейромедиаторов, необходимых для изменения поведения хозяина, или сопряженный с манипуляцией риск быть съеденным “тупиковым” хищником, или упомянутая выше гибель одного представителя клона ради изменения поведения хозяина — все это примеры затрат на манипуляции (Poulin, 1994; Poulin et al., 2005). В идеале затраты на манипуляции следует выражать в уменьшении приспособленности паразитов (а еще точнее, в уменьшении частоты встречаемости аллелей их генов) в связи с этими затратами. Но приспособленность — понятие весьма запутанное (Докинз, 2010, гл. 10) и не слишком хорошо поддающееся измерению, поэтому на практике исследователи используют так называемые фенотипические черты, связанные с приспособленностью (fitness-related traits), такие как скорость роста, размер, плодовитость и т.п. (Maure et al., 2011, Kingsolver, Huey, 2008).
Но вернемся к разделению затрат. Представим себе, что для достижения оптимального, с точки зрения паразита, фенотипа хозяина ему необходимо затратить X единиц энергии. Также для простоты предположим, что потенциально паразит может справиться с задачей манипуляции поведением хозяина в одиночку. Тогда с увеличением численности инфрапопуляции вклад каждой отдельной особи паразита в манипуляцию пропорционально уменьшается. Скажем, если в хозяине одновременно паразитируют пять паразитов одного вида и возраста, то вклад каждого паразита будет равен Х/5. Оставшиеся 4Х/5 от максимально возможных затрат на манипуляцию паразит может пустить на какие-то другие цели, например собственный рост и развитие (Poulin, 1994; Weinersmith et al., 2014). Таким образом, с увеличением размера инфрапопуляции у каждого индивидуума паразита появляется возможность “сэкономить” ресурсы, затрачиваемые на манипуляцию. Если паразиты относятся не только к одному виду, но и одному клону, то разделение затрат будет, видимо, максимально близким к справедливому при условии, что это разделение не приводит еще и к разделению “обязанностей” между особями внутри популяции паразитов и ее расщеплению на касты (см. ниже).
Если же паразиты относятся к разным клонам, то между ними возникает конкуренция и некоторые из них могут попытаться “сжульничать”, стремясь уменьшить свой собственный вклад в манипуляцию за счет остальных (Poulin, 1994). И в соответствии с правилом Гамильтона (Hamilton, 1964), чем сильнее различие между клонами, тем больше вероятность “жульничества” и меньше шансов, что отношения в инфрапопуляции будут альтруистичными, а разделение затрат равномерным. Предполагается, что такого рода кооперация достаточно распространена в природе, однако продемонстрировать напрямую затраты на манипуляцию и разделение этих затрат довольно сложно на практике. См. Пулен (Poulin, 2005), где описывается несколько “необычных” систем паразит —хозяин, в которых затраты на манипуляции достаточно очевидны.
Ранее было высказано несколько рабочих гипотез, поддержка которых эмпирическими данными может достаточно убедительно, хотя и косвенно, свидетельствовать о затратах на манипуляции и разделении этих затрат. Например, с увеличением численности инфрапопуляции скорость роста и развития паразитов и/или их плодовитость должны увеличиваться (Poulin, 1994; Maure et al., 2011). Сложность с этим предположением состоит в том, что с увеличением численности паразитов в организме хозяина растет и конкуренция за ресурсы. А значит, выигрыш в ресурсах, связанный с уменьшением затрат на манипуляцию, часто маскируется их уменьшением из-за конкуренции (Brown et al., 2003). Поэтому в природе гораздо чаще встречается отрицательная корреляция между интенсивностью заражения паразитами и их размерами и/ или плодовитостью (Brown et al., 2003). Считается, что в тех случаях, когда паразиты малы по сравнению с размерами хозяина, а их численность в его организме относительно невелика, конкуренция между паразитами снижается и можно обнаружить положительную корреляцию между численностью паразитов и скоростью их роста, связанную с уменьшением затрат каждого индивидуума на манипуляции (Weinersmith et al., 2014).
Действительно, полевые исследования показали, что трематоды Е. californiensis, паразитирующие в мозге фундуловых рыбок F. parvipinnis и манипулирующие их поведением, тем крупнее, чем выше интенсивность заражения паразитами. Позднее Гопко с соавт. (2014; Gopko et al., 2017b) исследовали рост других трематод-манипуляторов Diplostomum pseudospathaceum в зависимости от размеров инфрапопуляции паразита. Исследователи экспериментально заразили два вида рыб (верховку Leucaspius delineatus и радужную форель Oncorhynchus mykiss) и обнаружили, что спустя 2—3 нед. после начала роста паразиты в рыбах, зараженных сильнее, достигали более крупных размеров, чем в рыбах, менее зараженных. Заметим, что речь в данном случае идет о неинвазионных паразитах-манипуляторах, поскольку “незрелые” метацеркарии D. pseudospathaceum меняют поведение своих промежуточных хозяев — рыб — в сторону большей осторожности (Gopko et al., 2015).
Другое предположение, потенциально позволяющее обнаружить затраты на манипуляцию, состоит в том, что в зависимости от условий окружающей среды манипуляция может быть более или менее оправданной, и, если паразит поставлен в условия, когда менять поведение хозяина бессмысленно, он может перестать манипулировать или уменьшить свой вклад в манипуляцию и направить сэкономленные ресурсы на рост и развитие. Например, если неинвазионный паразит старается сделать своего хозяина более осторожным, то в относительно безопасной окружающей среде, где нет хищников, паразит может вкладывать в манипуляцию меньше, чем в среде с хищником (Гопко и др., 2014; Gopko et al., 2017b). Такая гипотеза может показаться фантастичной, поскольку предполагает, что, даже находясь в теле хозяина, паразит способен определить (почувствовать) присутствие хищника в окружающей среде. Как ни странно, существуют вполне убедительные примеры того, что паразиты способны по-разному манипулировать поведением своих хозяев и даже принимать стратегическое решение относительно своего жизненного цикла, ориентируясь (сейчас нам неважно непосредственно или опосредованно) на химические сигналы из внешней среды.
Так, было обнаружено (Vyas et al., 2007), что Toxoplasma по-разному влияет на изменения поведения хозяина (крысы) в зависимости от силы химического стимула (запаха кошки). Напомним, что токсоплазма манипулирует поведением грызунов, ослабляя их врожденное отвращение к запаху кошки. В другом исследовании (Lagrue, Poulin, 2007) выяснилось, что трематоды Coitocaecum parvum способны определять, есть ли в среде подходящий окончательный хозяин или нет, и, в зависимости от этого, определять, имеет ли смысл достигать преждевременной зрелости (прогенез) в организме промежуточного хозяина. В этом случае паразиту не нужно попадать в организм окончательного хозяина, чтобы завершить свой жизненный цикл.
Позднее было обнаружено (Гопко и др., 2014), что в безопасной среде, где нет необходимости манипулировать поведением хозяина (верховки), метацеркарии D. pseudospathaceum растут быстрее, чем в среде, где постоянно присутствует угроза стать жертвой неподходящего хищника. Этот результат имеет несколько возможных объяснений, но наиболее правдоподобным из них является то, что паразиты уменьшают свои затраты на манипуляции в среде, где нет острой необходимости менять поведение хозяина.
Разделение затрат в инфрапопуляции, состоящей из клонов или близких родственников, может, по всей видимости, привести к тому, что часть паразитов полностью сосредоточится на манипуляциях (или решении каких-то других, несвязанных с размножением задач). Другая часть будет вкладывать свои ресурсы исключительно в собственный рост и развитие, т.е. фактически произойдет формирование каст и эусоциальности. В этом нет ничего невероятного, поскольку наличие каст у трематод уже было обнаружено (Hechinger et al., 2011), хотя такое “разделение труда” не было результатом деления на манипуляторов/не манипуляторов, а скорее на “солдат” и особей, ответственных за размножение. Трематоды Himastla sp.. паразитируют в улитках Cerithidea californica, населяющих солоноватоводные марши на калифорнийском побережье Тихого океана. Стадия трематоды, обитающая в улитке — редия, может существовать в двух морфах: крупной и мелкой. Это не наследуемый признак, а дифференциация, вызванная факторами внешней среды, поскольку к разным морфам могут относиться представители одного клона. Было установлено, что крупные формы практически неподвижны и отвечают исключительно за размножение, в то время как мелкие “мини-редии” выполняют функцию “солдат” — защитников более крупных особей своего клона.
Мини-редии активно двигаются, обладают относительно крупным ротовым аппаратом, часто встречаются в местах, где другие паразиты проникают в организм хозяина, и даже активно атакуют представителей других видов и других клонов паразитов (Hechinger et al., 2011). Аналогичное разделение на касты было обнаружено и в другой системе паразит — хозяин (трематода Philophthalmus sp.—улитка Zeacumantus subcarinatus) (Leung, Poulin, 2011). Более того, оказалось, что Philophthalmus sp. способен корректировать свой вклад в разные морфы в зависимости от условий среды. В более крупных улитках доля мелких форм от всего числа редий была ниже, чем в улитках меньшего размера. При этом общая численность редий Philophthalmus sp. положительно коррелировала с размерами хозяина. Авторы статьи объяснили эти соотношения следующим образом. По мере роста хозяина растет отношение объема его тела к поверхности. Число редий растет пропорционально объему тела хозяина, а вероятность проникновения конкурентов (других паразитов) увеличивается лишь пропорционально площади покровов хозяина. Стало быть, с увеличением размеров улитки поверхность, которую должна “патрулировать” каждая миниредия, уменьшается, а значит, и доля их в инфрапопуляции тоже должна уменьшаться (Leung, Poulin, 2011). Если авторы статьи правы, то здесь мы имеем дело с еще одним примером того, как паразиты регулируют особенности своего жизненного цикла в зависимости от условий окружающей среды и плотности инфрапопуляции. Отметим, что гипотезу эусоциальности у трематод разделяют далеко не все паразитологи (см., например, Galaktionov et al., 2015 с возражениями).
IV. Паразитические манипуляции и их роль в экосистеме
Долгое время роль паразитов в экосистемах считалась пренебрежимо малой и фактически игнорировалась (Hudson et al., 2006; Lafferty, 2008; Johnson et al., 2010; Lefevre et al., 2009). Нельзя сказать, чтобы эти представления основывались на каких-то твердо установленных фактах, скорее традиционно паразиты больше интересовали медиков, ветеринаров и собственно паразитологов, чем экологов. Считалось, что биомасса паразитов незначительна, включение их в трофические сети необязательно, и главное, они плохо вписываются в существующие экологические модели и представления (Lafferty, 2008; Johnson et al., 2010). Разумеется, никакого заговора экологов против паразитов не существовало, и в последние десятилетия XX века шло медленное и неуклонное накопление знаний о важной роли паразитов в экосистемах, но по-настоящему плотину прорвало уже в новом тысячелетии. Как-то неожиданно выяснилось, что почти все наши представления о паразитах в экосистемах необычайно далеки от истины.
Оказалось, что, во-первых, их биомасса в водных сообществах, как правило, не меньше, биомассы многих других групп организмов, например, хищников (Lafferty, 2008; Kuris et al., 2008; Preston et al., 2013). Во-вторых, паразиты составляют около 50% от общего видового разнообразия экосистем (Hudson et al., 2006). Следовательно, игнорировать их роль в трофических сетях стало трудно, поскольку паразиты могут участвовать более чем в трех четвертях от всех трофических связей в экосистеме (Lafferty et al., 2006). Наконец, паразиты могут служить немаловажным источником пищи для различных животных, включая людей, а питание свободноживущими стадиями паразита может в свою очередь служить важным сдерживающим фактором распространения инфекций (Johnson et al., 2010; Burge et al., 2016). Так, организмы-фильтраторы в водных экосистемах способны элиминировать существенную часть расселительных стадий паразитов, препятствуя передаче инфекции (Burge et al., 2016).
Другое важное направление исследований и размышлений — изменение роли паразитов в экосистемах в связи с глобальными изменениями климата (Lohmus, Bjorklund, 2015; MacLeod, 2016). Разумеется, к каждой системе паразит — хозяин необходим отдельный подход, но теоретические соображения заставляют предположить, что в общем случае роль паразитов в экосистемах в ближайшие десятилетия будет только возрастать (Lohmus, Bjorklund, 2015). Отдельного разговора заслуживает влияние паразитов на исход конкуренции между двумя видами, например нативными видами и видами-вселенцами (Gozlan et al., 2005; Dunn et al., 2012).
В чем ученые оказались правы, так это в том, что паразиты плохо вписываются в общепринятые экологические модели и представления о базовых характеристиках экосистемы. Паразитические манипуляции — как раз одно из связанных с паразитами явлений, истинную роль которых в экосистемах еще только предстоит оценить. Существующие работы, однако, показывают, что паразиты и их манипуляции могут играть важнейшую роль в сближении трофических уровней экосистемы и стабилизации связей между ними (Hudson et al., 2006; Lafferty, 2008). Паразиты подобны клею, удерживающему вместе все звенья трофической цепи (Lafferty, 2008).
Что понимать под этими утверждениями? Вспомним, что паразиты-манипуляторы могут делать своих хозяев в десятки раз более доступными для потенциального хищника. Так, Лафферти и Моррис обнаружили, что рыбы, зараженные трематодами Euhaplorchis sp., в тридцать раз чаще попадают в клюв рыбоядной птицы, чем незаряженные рыбы (Lafferty, Morris, 1996). Аналогичное соотношение (разница больше, чем на порядок) обнаружили и финские исследователи, изучавшие влияние трематоды D. pseudospathaceum на поведение микижи (Seppala et al., 2004). Следует, правда, оговориться, что роль хищника в их исследовании выполнял человек, вооруженный сачком. Многочисленные исследования, проведенные на системе скребень — бокоплав, показали, что и в этом случае заражение паразитом существенно увеличивает шансы рачка стать добычей следующего хозяина. Так, бокоплавы G. pulex, зараженные скребнем Р. laevis, были в 2—4 раза более доступной пищей для рыб (окончательных хозяев паразита), чем незараженные особи (Bakkeret al., 1997; Kaldonski et al., 2009; Dianne et al., 2011). Таким образом, паразитические манипуляции способны очень сильно влиять на поток вещества и энергии между трофическими уровнями. Если теперь мы вслед за Вуд и Джонсоном (Wood, Johnson, 2015) проведем мысленный эксперимент и уберем паразитов из экосистемы, то обнаружим, что взаимоотношения между хищниками и их жертвами в такой экосистеме заметно изменятся, и, как знать, возможно, что приспособления хищника, вроде сильных мышц и острых когтей, окажутся вторичны по сравнению с той форой, которую может дать хищнику паразит, манипулирующий поведением жертвы или просто ослабляющий ее.
Приведенные примеры касались отдельных систем хищник —жертва, модифицируемых паразитом. А предпринимались ли попытки оценить влияние паразитических манипуляций на экосистему в целом? Понятно, что это непростая задача. Интернациональная группа ученых под руководством К. Лафферти изучала влияние волосатиков на поток вещества между лесными и озерными экосистемами (Sato et al., 201 la, b, 2012). Напомним, что волосатики манипулируют поведением своих хозяев — наземных насекомых, заставляя их прыгать в воду (Thomas et al., 2002), где паразиты завершают свой жизненный цикл как свободноживущие черви, а вот останки мертвых насекомых могут служить пищей различным водным животным. Например, наземные прямокрылые, падающие в водоем, могут составлять до 60% рациона кунджи (Salvelinus leucomaenis japonicus), обитающей в ручьях на о. Хонсю, Япония (Sato et al., 201 la). При этом подавляющая часть прямокрылых насекомых попадали в ручьи именно в результате манипуляции волосатиков: лишь каждый двадцатый из кузнечиков, попавших в ручей, не был заражен паразитом (Sato et al., 201 la). Более того, проведенные в полевых условиях эксперименты показали, что в отсутствие падающих в водоем насекомых рыбы переходят на более активное питание менее подходящей пищей — бентосными организмами.
Если же в водоеме достаточно насекомых, попадающих в него с берега, давление хищников (рыб) на бентосные организмы уменьшается, а увеличение численности бентоса в свою очередь приводит к тому, что в водоеме уменьшается биомасса бентосных водорослей. Кроме того, в водоемах, куда поступает достаточное количество насекомых с берега, быстрее происходит разложение листового опада (Sato et al., 2012). Здесь стоит отметить, что в ручьях и верховьях рек разложение листового опада — важнейший процесс, влияющий на наличие пищи в водных экосистемах (см. Moretti et al., 2007). Сато с соавт. (Sato et al., 2011b) удалось выяснить и то, какие факторы на суше могут влиять на зараженность прямокрылых волосатиками, а значит, и вероятность их попадания в водоем. Оказалось, что в ручьях, расположенных в нетронутых лиственных лесах, численность волосатиков выше, чем в лесах, где велика доля искусственных посадок хвойных деревьев. Интересно, что на численность кузнечиков, основных хозяев волосатиков на исследованных участках, площадь посадок никак не влияла. Таким образом, в серии работ Т. Сато с соавт. удалось показать, что паразитические манипуляции могут в значительной степени контролировать поток вещества и энергии между наземными и водными экосистемами. Изменение масштабов этого контроля приводит к заметным каскадным эффектам в водных экосистемах, причем немалую роль в возникновении этих эффектов может играть хозяйственная деятельность человека. При этом все упомянутые эффекты были обнаружены при изучении всего лишь одной системы паразит — хозяин, в то время как в большинстве экосистем видов, связанных подобными взаимоотношениями, гораздо больше.
Отметим любопытную деталь, обнаруженную Сато с соавт. (Sato et al., 2011а). Паразиты не только контролировали интенсивность потока вещества с берега в водоем, но и время, когда этот поток был особенно интенсивным,— осень в Северном полушарии. Такой вид временного контроля нельзя не принимать в расчет в экологических исследованиях. Не стоит забывать что в приведенных выше примерах речь шла о манипуляциях “зрелых” инвазионных паразитов. Напомню, что неинвазионные паразиты, напротив, усиливают защитные адаптации хозяина. Причем эти фенотипические изменения предшествуют по времени манипуляциям инвазионных паразитов (Parker et al., 2009; Dianne et al., 2011).
Теперь давайте представим себе экосистему в умеренном поясе Северного полушария Земли, например, озеро. Доминирующим видом брюхоногих моллюсков в таком озере вполне может быть большой прудовик Lymnaea stagnalis, а до половины популяции прудовиков могут быть заражены паразитическими трематодами D. pseudospathaceum. Диплостомум — очень распространенный паразит большого числа видов пресноводных рыб, которых заражают церкарии — расселительная стадия паразита, производящаяся в организме улитки (Valtonen, Gibson, 1997). При этом диплостомум —паразит-манипулятор. Пока паразит неинвазионен он меняет поведение хозяев в сторону большей осторожности. Когда же он достигает “зрелости”, то ослабляет защитное поведение хозяина, делая его более доступной добычей для рыбоядной птицы (окончательного хозяина) по достижении “зрелости” (Gopko et al., 2017а; Seppala et al., 2004). При температурах ниже 9—10 °С улитки не производят или почти не производят церкарий (Gopko et al., 2015). Однако когда вода прогревается выше порогового значения, а солнечное освещение становится ярким, улитки начинают производить тысячи церкарий за считанные часы (Lyholt, Buhmann, 1996). Что же происходит в естественных условиях? Наступает весна, вода в озере прогревается, развиваются личинки и мальки рыб, многие из которых примерно в одно и то же время заражаются диплостомумом. Это означает, что в течение нескольких недель, которые требуются паразиту для развития (паразит неинвазионен), значительная доля рыб в популяции более осторожна по сравнению с “нормальными”, не зараженными диплостомумом особями. Несколько недель спустя паразиты “созревают” и большая доля рыб в водоеме подвергается манипуляциям в противоположном направлении. Учитывая, что сходная картина вполне может наблюдаться и для других видов паразитов, можно представить, сколь значительное влияние такое переключение хозяев с усиленного защитного поведения на ослабленное может иметь на перенос энергии в экосистеме. Однако, насколько нам известно, экспериментально этот вопрос до сих пор не изучался.
Даже с такой задачей, как вычисление биомассы паразита в водоеме, возникают проблемы, связанные с манипуляциями фенотипом хозяина.
Вернемся к примеру с моллюсками В. cumingi, зараженными трематодой С. batillaria, описанному в предыдущем разделе. Казалось бы в этом случае можно вскрыть моллюска и аккуратно отделив ткани паразита от тканей хозяина подсчитать биомассу трематоды. Однако напомним, что С. batillaria меняет поведение, пищевые предпочтения и морфологию улитки, вдобавок полностью кастрируя хозяина, чтобы направить все потребляемые ею ресурсы на благо паразита.
Заметим, что кастрация хозяина в этом случае необратима, а это означает, что на протяжении всей своей долгой (6—10 лет) по меркам беспозвоночных жизни моллюск будет производить только потомство паразита, а никак не свое собственное. При этом зараженные трематодой С. batillaria моллюски могут составлять почти половину от всей популяции В. cumingi (Miura et al., 2006). Возникает парадоксальная ситуация, когда то, что по классическим представлениям принято называть одним видом, на самом деле разделено на две части, отличающиеся по своему поведению, пищевым предпочтениям, строению и, что самое важное, создающие копии двух совершенно разных наборов генов (Miura et al., 2006). Зараженные моллюски воспроизводят гены паразита, а незараженные — гены моллюска. При этом зараженные и незараженные улитки занимают хоть и различные, но близкие экологические ниши и, вероятно, конкурируют за ресурсы. С точки зрения теории “расширенного фенотипа” сложившуюся ситуацию логично воспринимать как межвидовую конкуренцию между незараженными моллюсками и трематодой, обладающей сходным с моллюском фенотипом, но не генотипом (Miura et al., 2006).
Приведенное выше рассуждение может показаться отвлеченным, однако у него есть вполне очевидные практические следствия. Скажем, эколог, которому необходимо рассчитать биомассу паразитов и моллюсков в водоеме, должен определиться с тем, куда относить зараженных паразитами-кастраторами моллюсков: к расширенному фенотипу паразита или собственно к моллюскам.
В первом случае вся масса зараженных хозяев должна быть отнесена к биомассе паразита, в то время как при втором подходе биомассой трематод считается только масса спороцист и редий, паразитирующих в моллюске, а не вся масса хозяина. Исследований, посвященных роли паразитов в экосистеме, пока сравнительно мало, но в наиболее заметных работах последних лет используют первый подход (расчет биомассы расширенного фенотипа паразита — extended biomass) или по крайней мере учитывают его (Kuris et al., 2008; Preston et al., 2013). Здесь уместно добавить, что даже при “классическом” подходе биомасса паразитов в экосистеме оказывается весьма значительной. Так, в эстуариях она может превосходить биомассу консументов высшего порядка (top predators) (Lafferty et al., 2008; Kuris et al., 2008), а в озерных экосистемах биомасса одних только трематод сопоставима с биомассой большинства групп макробентоса, например личинок стрекоз, поденок, амфипод и пр. (Preston et al., 2013).
Паразитические манипуляции и изменение климата
Завершим наш разговор о роли паразитических манипуляций в экосистеме еще одним примером. На этот раз он будет связан с такой важной темой, как изменение климата.
Ацидификация океана уменьшает жизнеспособность существ с известковым скелетом, в том числе и моллюсков, поскольку делает поддержание такого скелета более затратным (Kroeker et al., 2013; MacLeod, Poulin, 2016). С другой стороны, многие трематоды, манипулирующие фенотипом своих хозяев, меняют метаболизм моллюска таким образом, чтобы он производил более толстую и прочную раковину. МакЛеод и Пулен (MacLeod, Poulin, 2016) содержали моллюсков в воде, показатели pH которой были близки к предсказанным в 2100-м и 2300-м гг., если процесс ацидификации не замедлится.
Они выяснили, что повышение кислотности воды достоверно увеличивало смертность не зараженных паразитами моллюсков, в то время как выживаемость моллюсков, зараженных трематодами, оставалась неизменной несмотря на изменения pH (MacLeod, Poulin, 2016). Таким образом, зараженные моллюски могут оказаться более устойчивы к глобальным климатическим изменениям по сравнению с незараженными. Трудно, однако, сказать, насколько полезным для моллюсков окажется такой симбиоз, поскольку, во-первых, паразиты оказывают на фенотип хозяина и другие воздействия, которые могут быть не столь позитивны, а во-вторых, важнейшим механизмом, позволяющим паразиту перенаправить ресурсы хозяина на строительство более толстой раковины, служит кастрация моллюска (MacLeod, Poulin, 2016). С другой стороны, моллюски могут эволюционировать в сторону большей устойчивости к воздействию паразита на их организм, т.е. сохранять, пусть и пониженную, плодовитость, используя при этом генетический аппарат паразита, чтобы подстроить свой метаболизм к меняющимся условиям окружающей среды.
Заключение
Многие паразиты способны манипулировать фенотипом своих хозяев с целью увеличить свою приспособленность. Эти манипуляции порой столь ярки и причудливы, что удивительно, почему ученые обратили на них серьезное внимание всего лишь 40—50 лет тому назад. С тех пор паразитические манипуляции постепенно превратились из научного курьеза в общепринятый феномен, важная роль которого в природных экосистемах не вызывает сомнений (Dawkins, 2004).
К настоящему моменту известны уже сотни примеров паразитических манипуляций, и именно они в первую очередь приходят в голову в качестве объяснения необычного поведения зараженных животных. Есть ряд фундаментальных положений, позволяющих утверждать, что в эволюционной гонке вооружений в системе паразит —хозяин именно паразит, как правило, одерживает верх и является бенефициаром изменений фенотипа хозяина.
Стратегии манипулирования паразитов разнообразны и зависят от особенностей их жизненного цикла. В нашем обзоре мы старались проиллюстрировать основные стратегии манипулирования характерными примерами. Целью манипуляции моноксенных паразитов часто бывает увеличение вероятности встречи хозяина с представителями своего вида для передачи инфекции и/или максимально успешное распространение инфекции. Паразитоиды отличаются изощренными и часто эффектными манипуляциями, обычно завершающимися гибелью хозяина, причем место, время и условия его гибели обычно четко определяются паразитом.
Напротив, паразиты, использующие хозяина для производства своих расселительных стадий, не заинтересованы в смерти хозяина. Манипуляции таких паразитов направлены на перестройку организма хозяина с целью максимизировать численность своих потомков и минимизировать риск ранней и неожиданной смерти хозяина. Внешними проявлениями такой манипуляции часто являются паразитарная кастрация, гигантизм, изменение пищевых предпочтений хозяина и усиление его защитных приспособлений. Если эволюционный успех паразита зависит от встречи организма-переносчика и потенциального хозяина, то основная цель манипуляций паразита — увеличить частоту таких встреч, например, увеличив пищедобывающую активность переносчика, если инфекция передается через укус. Наконец, жемчужиной в короне паразитов-манипуляторов по праву считается PITT — передача по трофической цепи, индуцированная паразитом. В рамках этой манипулятивной стратегии паразит саботирует защитное поведение хозяина, делая его более доступной добычей для хищника — потенциального хозяина паразита. Важно отметить, что паразит вовсе не обязан манипулировать лишь какой-то одной чертой фенотипа хозяина. Часто его манипуляции многомерны, т.е. охватывают сразу несколько фенотипических черт, а если жизненный цикл паразита допускает различные способы передачи инфекции, то он способен задействовать одновременно несколько стратегий манипулирования. Помимо внешнего эффекта, паразитические манипуляции могут играть важную роль в функционировании экосистем и, возможно, оказывать заметное воздействие на человеческие общества.
Паразитическая манипуляция, как и любая адаптация, формируется под воздействием естественного отбора и в отношении нее справедливы те же вопросы, что и в отношении других адаптаций. Как часто и при каких условиях она возникает, какие формы она может принимать в зависимости от условий, насколько она пластична и способна модифицироваться под влиянием окружающей среды и, наконец, сколько ресурсов она требует? В зависимости от условий отбора манипуляции инвазионных паразитов должны быть специфичны или неспецифичны. Предполагается, что большинство таких манипуляций специфично, но экспериментально это было показано лишь в единичных случаях. Манипуляция неинвазионных паразитов, цель которой сделать хозяина более осторожным пока паразит не достигнет инвазионной стадии, напротив, не должна быть специфичной, хотя и может быть таковой. Поскольку “зрелые” и “незрелые” паразиты часто манипулируют поведением хозяина в противоположных направлениях, между ними может возникнуть конфликт, у которого возможны различные исходы. Вопреки теоретическим предпосылкам, на практике в таких конфликтах, как правило, побеждают инвазионные паразиты, хотя количество исследований по теме пока что ничтожно мало.
Как любая другая адаптация, манипуляция требует от бенефициара определенных затрат энергии. Их трудно оценить, однако существует несколько исследований, где затраты на манипуляции были косвенно обнаружены. Если в организме хозяина несколько паразитов одного возраста и вида, а тем более клона, то паразиты могут делить затраты на манипуляцию поведением хозяина, что представляет собой некоторую форму кооперации. В пределах одного клона такое разделение затрат может приводить и к разделению труда, когда часть паразитов специализируется на размножении, а другая на каких-то других функциях (манипуляциях, защите и пр.). В конечном итоге такое разделение “обязанностей” внутри популяции может привести к образованию каст и эусоциальности.
На протяжении долгого времени значение паразитов в экосистемах недооценивалось, и только в последние два десятилетия положение начало существенно меняться. Паразитические манипуляции — явление, плохо укладывающееся в современные экологические представления. Паразиты играют роль модификаторов, регулирующих отношения в трофических сетях и сближающих трофические уровни. Оценить эту роль количественно трудно, но существующие исследования показывают, что она может быть велика и оказывать существенное воздействие как на отдельные межвидовые взаимодействия, так и на экосистему в целом.
Статья подготовлена при поддержке РФФИ (гранты № 14-04-00090а и 17-04-00247а) и РНФ (грант № 14-14-01171).
Источник Журнал общей биологии. 2017. Т.78. №6.