Черноголовый зелёный дятел Picus erythropygeus, вид с богатой каротиноидной окраской (самец и самка)
В продолжение темы эволюции в пространстве возможностей (Дарвин и Вавилов)
А. В. Бадяев
Факультет экологии и эволюционной биологии, Университет Аризоны, Туксон 85721, США
Резюме. Бόльшая часть пигментации оперения птиц производится каротиноидами – органическими пигментами, которые птицы сами синтезировать не могут, а потребляют с едой. Соответственно, механизмы, модулирующие зависимость от внешних каротиноидов, играют ключевую роль в эволюции окраски птиц. Несмотря на миллионы лет эволюции, диверсификация синтеза каротиноидов у современных птиц, в основном, отражает структуру глобальной сети каротиноидного синтеза, возникшего задолго до появления класса Птиц. Эта структура показывает, что разнообразие окраски напрямую зависит от избыточного разнообразия исходных пищевых каротиноидов, а также позволяет нам предсказывать частоту конвергенций в окраске оперения и прогнозировать потенциал диверсификации каротиноидной окраски у разных таксономических и экологических групп птиц.
В свою очередь, наблюдаемые отклонения от этих структурных ожиданий дают отправную точку для изучения механизмов, влияющих на эволюцию каротиноидной окраски оперения у птиц.
Немногие группы позвоночных могут сравниться с птицами по разнообразию окраски и особенно пигментной окраски оперения, которая производится каротиноидами. Однако, несмотря на интенсивные исследования, главные вопросы в этой области остаются открытыми. Почему разнообразие пигментной окраски распределено так неравномерно между разными таксономическими группами (Baker, Parker, 1979; Savalli, 1995; Hill, McGraw, 2006)? Особенно парадоксально неожиданное появление яркой “экзотической” окраски в группах монотонно окрашенных видов.
Где сохраняются элементы этого разнообразия в процессе эволюции, когда они не являются частью фенотипа родственных видов? И что происходит с этими элементами и их детерминантами, когда вид вымирает?
Что обусловливает так часто наблюдаемую конвергенцию окраски между видами и группами, которые зачастую очень далеки друг от друга в историческом и экологическом плане (Коблик, Мосалов, 2006; Мосалов, Коблик, 2017)? Это независимое нахождение одинаковых решений в процессе эволюции или рекомбинация ограниченного комплекта сохраняемых элементов?
Хотя мы не знаем ответов на эти вопросы, понятно, что именно нам надо знать, чтобы на эти вопросы ответить. Проблема в том, что в эволюционной биологии мы предсказываем пути и закономерности прошедших процессов исходя из разнообразия и распределения признаков современных видов – фенотипических “островов в море исторических возможностей”. Однако современные виды не являются эволюционными стадиями друг друга – они независимы и поэтому зачастую представляют собой уникальные решения проблем, которые существовали во время их происхождения (Lewontin, 1974; Gould, 2002). Более того, в процессе эволюции организмов их новые адаптации часто включают в себя (и таким образом стирают) предыдущие адаптации (Chetverikov, 1926).
Другими словами, нам сложно выявить определяющие исторические пути между современными видами ровно потому, что этих путей никогда не существовало. Однако с элементами фенотипов (таких как гены, белки, элементы морфогенеза и т.п.) ситуация обстоит иначе – эволюция зависит от их непрерываемой исторической связанности (Северцов, 1934; Dobzhansky, 1937; Шмальгаузен, 1938; Maynard Smith, 1970; Fontana, Schuster, 1998). Поскольку и прошлые и современные фенотипы являются временными агрегациями этих элементов (Huynen et al., 1996; Bershtein et al., 2006; Starr et al., 2017), то на каком-то уровне их биологической организации “острова современных фенотипов” должны быть объединены общей сетью зависимостей между их элементами (Van Valen, 1989; Gavrilets, 1999; Borenstein et al., 2008; Wagner, 2011; Morris et al., 2012; Nordbotten et al., 2018).
В этом обзоре мы рассмотрим, объясняет ли эта теория темпы и направления эволюции каротиноидной окраски у птиц. Птицы не могут синтезировать каротиноиды из не-каротиноидов и поэтому получают пищевые каротиноиды с едой, а в процессе линьки откладывают их в свежих перьях либо напрямую, либо после биохимической модификации (Brush, 1978, 1990; Goodwin, 1984; Britton, 1998). Несмотря на все разнообразие каротиноидной окраски, меньше чем 3% натуральных каротиноидов известны из оперения и других тканей птиц (Badyaev et al., 2015). Более того, все каротиноиды и биохимические реакции их синтеза, описанные у птиц, представляют собой очень малую и изолированную часть глобальной сети синтеза каротиноидов, возникшей в контексте бактериальной эволюции более чем миллиард лет до происхождения птиц (Liaaen-Jensen, Andrewes, 1972; Klassen, 2010).
Таким образом, биохимическая эволюция каротиноидов у птиц происходит в замкнутом, неожиданно малом, и древнем “ландшафте” с известными “входами” (соответствующие экологии вида пищевые каротиноиды) и известными возможными путями биохимической диверсификации (рис. 1a).
Поскольку нам также известны параметры биохимической эволюции у современных птиц, использующих этот ландшафт, то мы можем рассматривать, насколько эти две эволюционные диверсификации взаимозависимы, т.е. насколько топология и связанность древнего биохимического ландшафта отражается в темпах и направлениях эволюции каротиноидного оперения у современных птиц.
Например, неравномерное разнообразие окраски между таксономическими группами может объясняться разной биохимической связанностью (соединенностью) различных пищевых каротиноидов, потребляемых видами с разной экологией (рис. 1a). Периодическая конвергенция окраски может объясняться полной связанностью биохимической сети птиц – все узлы этой замкнутой сети достижимы из любых других узлов, поскольку только пищевые каротиноиды могут быть изолированными островами в сети птиц.
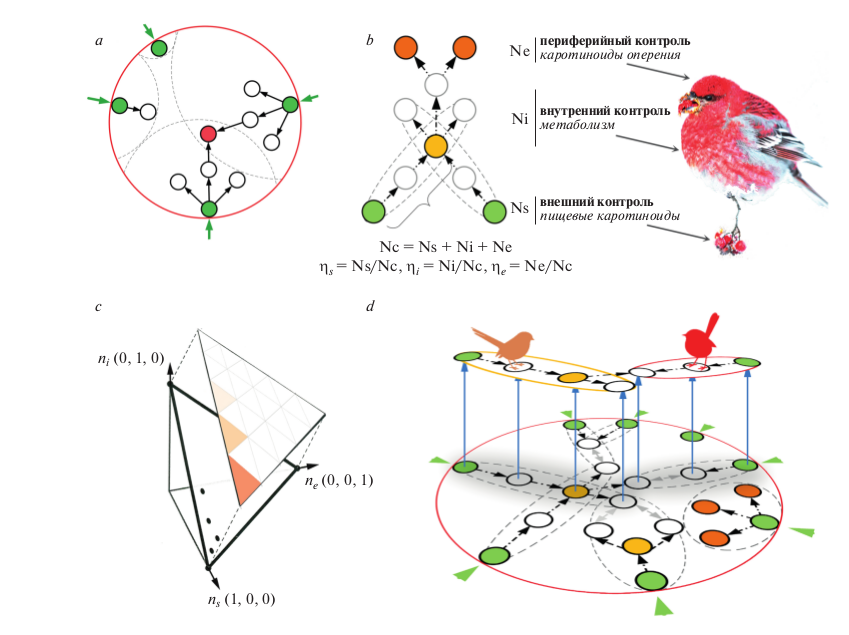
Рис.1. Основные концепции структурного подхода к изучению каротиноидной окраски птиц. (а) Удлинение и устойчивость метаболических путей взаимозависимы в замкнутых сетях каротиноидного синтеза птиц. Метаболическое удлинение (реакции, показанные стрелками) начинается с пищевых каротиноидов (зеленые кружки с внешними стрелками – разные группы птиц потребляют разные пищевые каротиноиды) и в процессе эволюции неизбежно соединяется с путями, начинающимися из других пищевых каротиноидов. Эволюционная устойчивость метаболизированного каротиноида (красный кружок) пропорциональна количеству пищевых каротиноидов, которые его производят. (b) Функциональное соответствие управляющих структур в сетях каротиноидов птиц. Внешние контрольные узлы соответствуют пищевым каротиноидам (зеленые кружки), внутренние контрольные узлы – некоторым метаболизированным каротиноидам (желтый), периферийные контрольные узлы – терминальным биохимическим разветвлениям, ведущим к каротиноидам оперения (красный). Пунктирными линиями обозначены биохимические модули, связывающие пищевые и производные каротиноиды, фигурная скобка обозначает длину пути (в реакциях), когда путь, начинающийся с одного пищевого каротиноида, сливается с путем от другого пищевого каротиноида в “вырожденном” узле (желтый). (c) Контрольный профиль каждой сети может быть показан как точка на троичной системе координат, определяемой пропорциями η s , η i и η e . Плотность этих точек в каждом сегменте показана интенсивностью цвета. (d) Внутренние контрольные узлы действуют как мосты между адаптациями, показанными здесь как специфичные для группы птиц модули (пунктирные эллипсы, включающие пищевые каротиноиды), и таким образом обеспечивают непрерывность эволюции.
Таким образом, эволюционные траектории, начинающиеся из разных “входов” – пищевых каротиноидов, – неизбежно (с разной, но известной частотой) встречаются в одних и тех же узлах внутри сети, объясняя периодическую конвергенцию окраски видов с разной экологией и историей (рис. 1a). Более того, этот подход позволяет понять связь между удлинением биохимических путей в синтезе каротиноидов оперения (и соответствующей экзотической, яркой или сложной окраской) и избыточностью путей их синтеза (их “вырождение” в математическом смысле, англ. “metabolic degeneracy”) – т.е. когда биохимические пути производят из разных пищевых каротиноидов один и тот же метаболизированный каротиноид (Edelman, Gally, 2001; Badyaev, 2007, 2019; Whitacre, Bender, 2010).
Избыточность путей компенсирует природную вариабельность пищевых каротиноидов и удлиняет период их непрерывной эволюции, предсказывая, что красочное оперение должно быть наиболее эволюционно устойчиво, более интегрировано с другими аспектами организма и наиболее подвержено эволюционной диверсификации (Badyaev et al., 2017). Этот подход также показывает, каким образом окраска, полностью зависящая от местных и постоянно меняющихся ресурсов (пищевые каротиноиды, потребляемые во время линьки), может, тем не менее, демонстрировать долговременную последовательную эволюцию (Higginson et al., 2016).
В этом обзоре мы покажем, что эти структурные решения имеют в своей основе эволюционные циклы управляемости биохимической сети (Liu et al., 2011) – периодические обретения и потери автономности ее функционирования (Badyaev et al., 2019). Структурный подход к изучению вариабельности окраски дает нам отправную точку для дальнейшего изучения механизмов, влияющих на ее эволюцию.
Материалы и методы
Каротиноидные метаболические сети 384 видов птиц (приложение S1 в Morrison, Badyaev, 2016) были построены на основе универсальной метаболической сети каротиноидного синтеза (Umeno et al., 2005). Все каротиноиды, обнаруженные в оперении, плазме и кожном покрове вида, были нанесены на карту “птичьего пространства” глобальной метаболической сети каротиноидов (Badyaev et al., 2015). В этой работе мы используем метаболические сети только для видов с каротиноидами в оперении. Протоколы и все данные вместе с экспериментальным подтверждением реакций приведены в приложениях к работам Бадяева и Моррисон (Badyaev et al., 2015; Morrison, Badyaev, 2016).
Мы построили ультраметрическое филогенетическое дерево из 1000 ультраметрических деревьев (приложение S2 в Badyaev et al., 2019), выбранных из (Jetz et al., 2012; 2014) и калибрированных ископаемыми с известной датировкой (Badyaevetal. 2015). Все филогенетические гипотезы и данные приведены в приложениях к публикации Моррисон и Бадяева (Morrison, Badyaev, 2016).
Реконструкция структуры биохимической сети предков в филогенетическом контексте требует оценки реакций, которые связывают каротиноиды и их ферменты в сетях близкородственных видов, а также реконструкции этих сетей с помощью либо парсимонии (Pál et al., 2005; Borenstein et al., 2008; Kreimer et al., 2008), либо методов максимальной вероятности (Ebenhöh et al., 2006; Mithani et al., 2009, 2009a; 2010).
Эволюционные изменения в структуре сетей, особенно обретения или потери реакций и узлов, были продемонстрированы сравнениями между известными предками и существующими видами (Mithani et al., 2011) и в лабораторной эволюции путей метаболизма (Nam et al., 2012).
Мы использовали модифицированный подход максимальной вероятности (Borenstein et al., 2008), чтобы проверить соответствие моделей эволюции сети в филогении и отследить изменения узлов и реакций одновременно. Протоколы, программы и данные опубликованы в работе Бадяева с соавторами (Badyaev et al., 2019). Чтобы сравнить функциональные и эволюционные ассоциации между каротиноидами (рис. 2b), мы вывели филогенетический профиль каждого каротиноида (Pellegrini et al., 1999). Профиль представляет собой бинарную строку, которая кодирует наличие (1) или отсутствие (0) каротиноида в каждом из современных видов и в 217 сетях предков. Сходство (коэффициент Джаккара) между филогенетическими профилями каждой пары каротиноидов использовалось для измерения того, как часто пары встречались в одном и том же виде. Пары каротиноидов с идентичными филогенетическими профилями эволюционируют как часть неизменных модулей, тогда как пары филогенетически различных каротиноида эволюционируют независимо и встречаются в разных модулях (Yamada et al., 2006; Zhao et al., 2007).
Расстояние между каждой парой каротиноидов было представлено наименьшим числом реакций между ними на полной биохимической сети каротиноидов. Протокол, тестирование метода и данные представлены в публикации Моррисон и Бадяева (Morrison, Badyaev, 2018).
Концепция управляемости сети измеряет легкость и способы ее изменения и эффективности (Zhou et al., 1995; Frank, 2018). Узлы сети, которые влияют на эти процессы, либо из-за их топологического положения, либо из-за связанности, называются контрольными (Liu et al., 2011; Moradi et al., 2017). Поскольку управляемость узла механически определяется тем, сколько соседних узлов он контролирует, разница между количеством входящих и выходящих реакций определяет потенциал управляемости узла (Yuan et al., 2013). Эта асимметрия позволяет разделить контрольные узлы на три общих класса (Ruths, Ruths, 2014).
Контрольные узлы, в которых нет входящих реакций, а есть только выходящие, мы называем внешними контрольными узлами (количество этих узлов в сети = Ns), контрольные узлы, в которых есть и входящие и выходящие реакции – внутренними контрольными узлами (Ni), а контрольные узлы без выходяших реакций – периферийными контрольными узлами (Ne) (рис. 1b).
Общее число контрольных узлов в каждой сети (Nc) было рассчитано с алгоритмом максимального совпадения Хопкрофта-Карпа (Hopcrpft, Karp, 1973; Commault et al., 2002) используя код Enthought Canopy в Python 2.7 и Network X 1.9 (Hagberg et al., 2008). Стандартизация контрольных узлов каждого класса с Nc дает контрольный профиль управления сетью (Ruths, Ruths, 2014), состоящий из пропорций ηs = Ns/Nc, ηi = Ni/Nc и ηe = Ne/Nc (рис. 1b). Мы представляем контрольный профиль каждой сети точкой на троичной плоскости координат ηs , ηi, ηe (рис. 1c). Протоколы и данные опубликованы в работе Бадяева с соавторами (Badyaev et al., 2019).
Результаты и обсуждение
Диверсификация сетей синтеза каротиноидов у птиц не отражает их филогенетическое родство и эволюцию. Более того, дендрограмма сходства синтеза каротиноидов (отражающая использование птицами глобальной сети каротиноидов) и дендрограмма родства птиц по молекулярным данным (калиброванная 12 ископаемыми и отражающая 108 млн. лет эволюции птиц) максимально различны (Badyaev et al., 2015). Идентичный результат найден и у других групп животных, которые не производят каротиноиды, но активно их используют (Kayser, 1982 ; Sefc et al., 2014). В то же время, эволюция каротиноидных сетей у птиц близко отражает структуру древней биохимической сети: различие в метаболизме сестринских видов птиц идентично развилкам в древней биохимической сети каротиниодов.
Узлы с бόльшей биохимической связанностью поддерживают бόльшую метаболическую диверсификацию птиц (рис. 2a) и расстояние между узлами в древней сети обусловливает их филогенетическое распределение среди птиц (рис. 2b) (Morrison, Badyaev, 2016; 2018). Сохранение изначальной структуры биохимической сети, по крайней мере в последние 50 млн. лет эволюции птиц, несмотря на их обширную экологическую дивергенцию, объясняется тем, что птицы рекомбинируют выборки биохимических модулей – каждый из модулей имеет свой пищевой каротиноид (соответствующий экологии), но неизменную внутреннюю структуру биохимических реакций (Morrison, Badyaev, 2016).
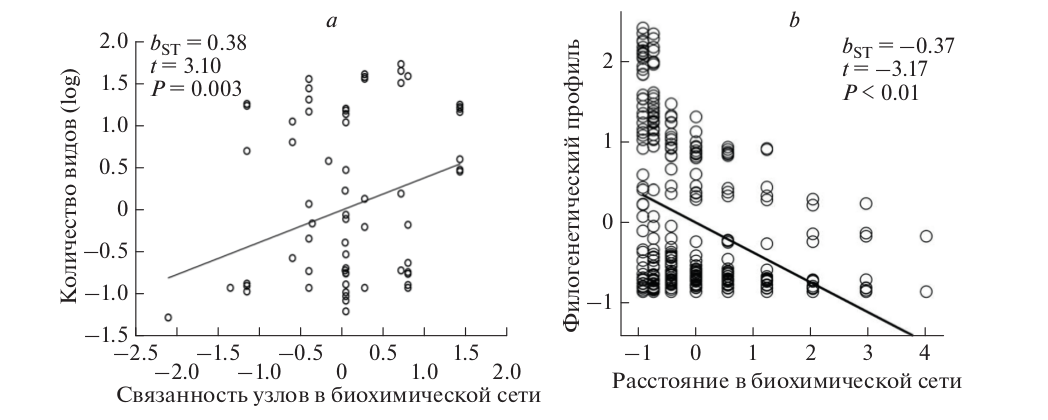
Рис. 2. Эволюционная диверсификация каротиноидной окраски птиц отражает структуру глобальной сети каротиноидного синтеза. (a) Количество видов птиц (log) с продуктом синтеза каротиноида (реализованная эволюционная диверсификация) как функция ферментной связанности этого каротиноида (в реакциях) в глобальной биохимической сети (потенциальная эволюционная диверсификация). (b) Сохранение структуры метаболической сети на протяжении эволюционной истории птиц. Каротиноиды, разделённые более короткими расстояниями (в реакциях) в глобальной метаболической сети, встречаются у одного и того же вида чаще, чем каротиноиды, разделенные более длинными расстояниями вне зависимоcти от эволюционного расстояния между видами. Показаны современные виды.
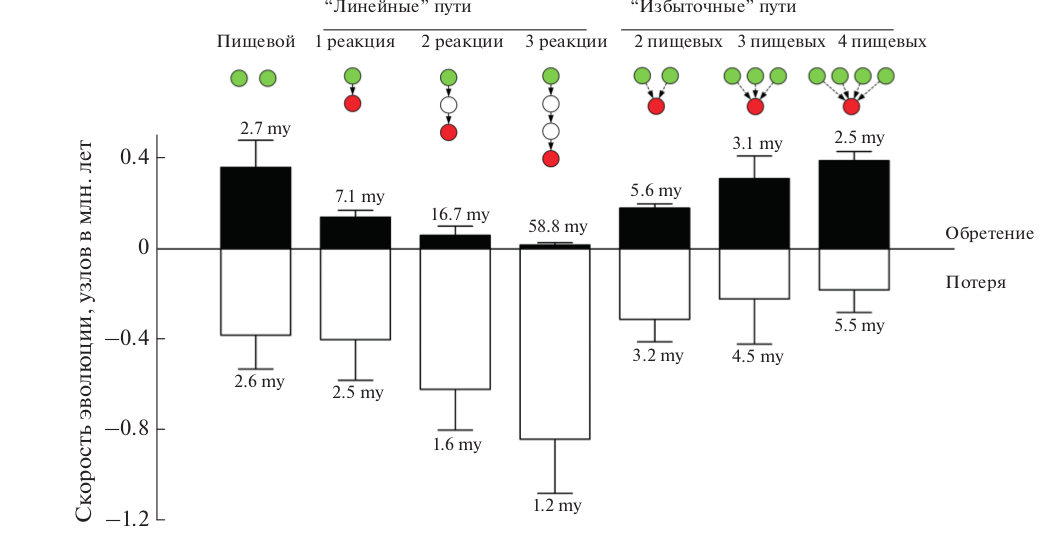
Рис.2. (c) Избыточность биохимических путей (“метаболическое вырождение”) необходима для эволюции сложной каротиноидной окраски. Скорость обретения и потери узлов (в миллионах лет ± 1 стандартное отклонение) относительно их расстояния (в реакциях) от пищевых каротиноидов по линейным (левая группа) и избыточным (правая группа) путям. Средняя частота потери пищевых каротиноидов (крайнее левое значение) устанавливает нижний порог, при котором возможно удлинение каротиноидных путей. Устойчивое эволюционное удлинение возможно только тогда, когда новый узел обретается чаще. Только избыточные пути, поддерживаемые >2 пищевыми каротиноидами, обеспечивают устойчивую эволюцию сети. При всех других сценариях доминируют потери, приводящие к сокращению функциональной сети и либо к застою, либо к сокращению каротиноидной окраски.
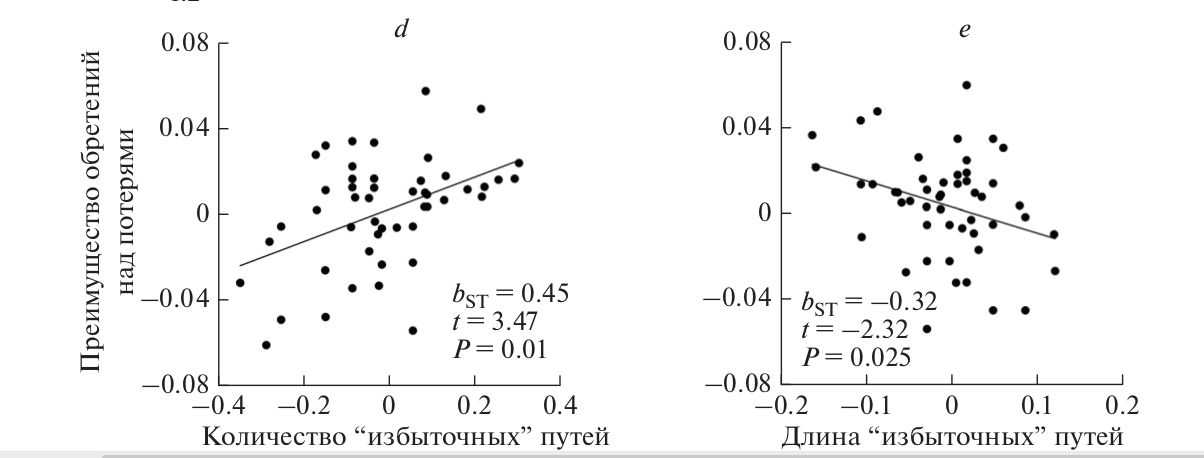
Рис.2. (d, e) Mетаболизированные каротиноиды, близкие к пищевым каротиноидам, а также поддерживаемые несколькими биохимическими путями, играют бόльшую роль в эволюции каротиноидной окраски оперения – в процессе эволюции они находятся быстрее и теряются реже. Регрессия обретения минус потерь узлов как функция (d) количества избыточных путей и (e) средней длины этих путей. a, b, d, e показывают частичную регрессию.
Эта комбинаторная эволюция объясняет, почему сестринские виды, обретающие и теряющие полные модули, могут так различаться в размере каротиноидной сети, обусловливающей окраску оперения, а исторически далекие виды могут быть идентично окрашены. Реконструкция биохимических сетей предков современных птиц показывает, что значительное удлинение биохимического пути только из одного пищевого каротиноида – т.е. в результате эволюционной модификации внутри одного модуля, маловероятно (рис. 2c) (Badyaev et al., 2015). Это вызвано частыми потерями пищевых каротиноидов (рис. 2c), которые делают весь модуль нефункциональным. Виды, зависящие в каротиноидном синтезе только от одного пищевого каротиноида (33 вида в нашей подборке), не достигают биохимических путей длиннее одной реакции (Badyaev et al., 2015). Для поступательной эволюции окраски (когда приобретения новых узлов – метаболизированных каротиноидов – превалируют над их потерями) необходима избыточность (англ. “redundancy”) разных пищевых каротиноидов (рис. 2c).
Несколько биохимических путей, которые начинаются из разных пищевых каротиноидов, но производят один и тот же метаболизированный каротиноид (метаболическая “вырожденность”), обеспечиваeт непрерывное функционирование сети несмотря на вариабельность индивидуальных пищевых каротиноидов в разных средах обитания (рис. 2c).
Все ярко окрашенные виды птиц в нашей подборке, у которых длина биохимических путей превышает 4 реакции от пищевого каротиноида, зависят от >3 разных пищевых каротиноидов (рис. 2c). Избыточность пищевых каротиноидов минимизирует эффект эволюционной лабильности внешних каротиноидов на эволюцию оперения у этих видов.
Концепция управляемости биохимической сети (см. Методы) позволяет идентифицировать контрольные узлы и реакции, регулирующие как функционирование сети, так и их изменения (Badyaev, 2019). Выведение контрольного профиля сетей каротиноидного синтеза для 384 видов птиц обнаружило неожиданно высокий уровень внутреннего контроля (рис. 3). Хотя внешний контроль доминирует у большинства видов (что ожидаемо для признаков полностью зависимых от внешней среды), структура биохимических путей у многих видов построена так, что она минимизирует зависимость от пищевых каротиноидов и, в основном, находится под внутренним контролем (рис. 3). Такая передача контроля происходит, когда обретение дополнительного пищевого каротиноида ведет к их избыточности, т.е. когда увеличение Ns ведет к увеличению ηi (Campbell et al., 2015).
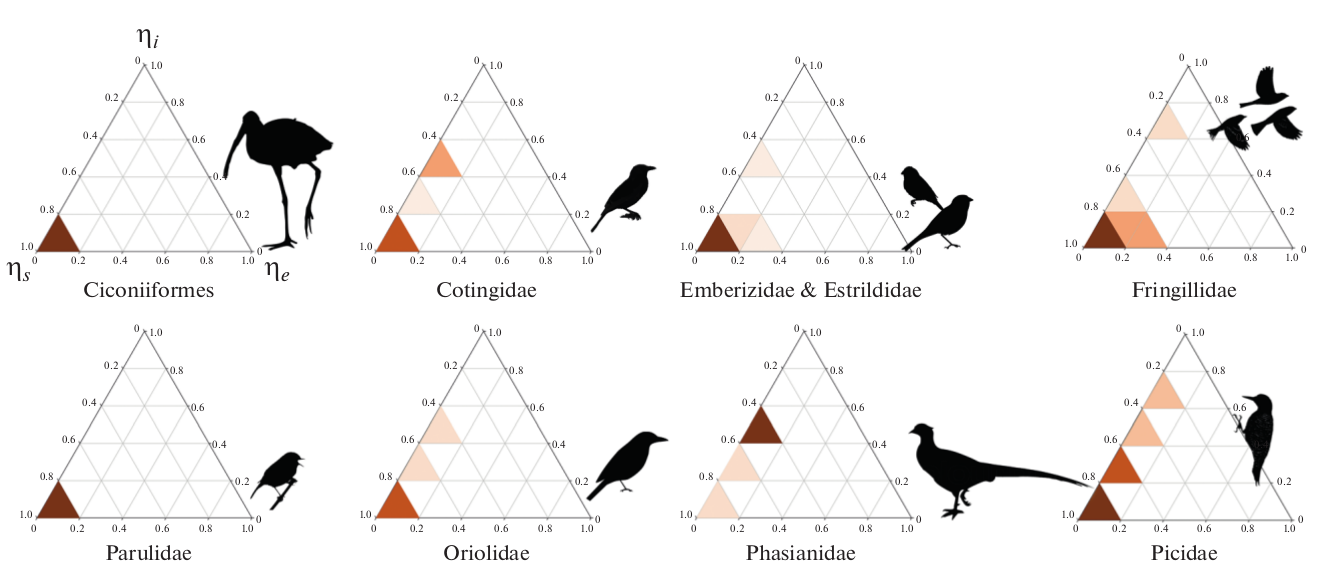
Рис. 3. Контрольные профили каротиноидных сетей некоторых групп птиц (по данным из приложения S3 в Badyaev et al., 2019). Тени указывают плотность сетей (с шагом 20%), которые имеют контрольные профили в этом пространстве. Хотя внешний контроль распространен во всех группах, ряд видов в группах Picidae, Fringillidae, Oriolidae и др. показывает значительный внутренний контроль (пропорция ηi).
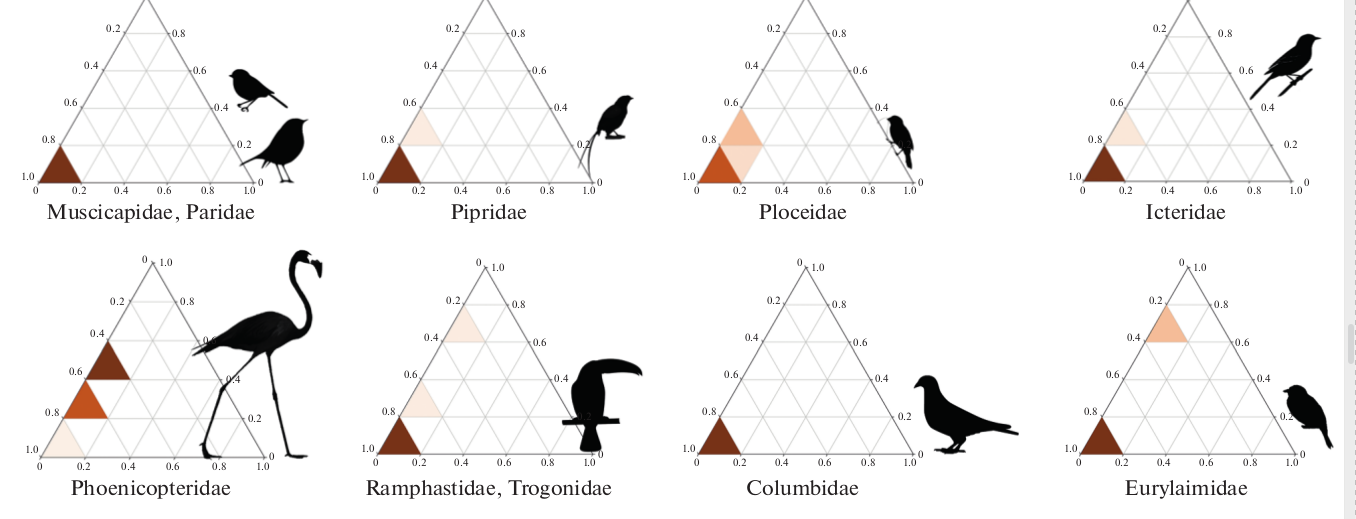 В контексте эволюции птиц это происходит, когда два или больше биохимических модуля соединяются в одном из внутренних узлов в процессе комбинаторной эволюции (Morrison, Badyaev, 2018). Каждый из этих модулей имеет свой пищевой каротиноид (который является внешним контролем), однако когда количество выходящих реакций узла соединения модулей оказывается больше, чем количество соединенных модулей, этот узел становится внутренним контролем (рис. 1b). Чем ближе к пищевому каротиноиду происходит соединение модулей (фигурная скобка в рис. 1b), тем быстрее избыточность пищевых каротиоидов приводит к внутреннему контролю сети.
В контексте эволюции птиц это происходит, когда два или больше биохимических модуля соединяются в одном из внутренних узлов в процессе комбинаторной эволюции (Morrison, Badyaev, 2018). Каждый из этих модулей имеет свой пищевой каротиноид (который является внешним контролем), однако когда количество выходящих реакций узла соединения модулей оказывается больше, чем количество соединенных модулей, этот узел становится внутренним контролем (рис. 1b). Чем ближе к пищевому каротиноиду происходит соединение модулей (фигурная скобка в рис. 1b), тем быстрее избыточность пищевых каротиоидов приводит к внутреннему контролю сети.
Интернализация контроля приводит к эволюционной диверсификации каротиноидных сетей по трем основным причинам. Во-первых, по определению, внутренние контрольные узлы имеют больше выходящих, чем входящих реакций и таким образом достигают большей метаболической диверсификации, которая позволяет им занимать большее количество внутренних узлов (т.е. метаболизированных каротиноидов) биохимической сети. Во-вторых, избыточность пищевых каротиноидов компенсирует природную вариабельность каждого из них, таким образом делая эксплуатацию внутренних узлов эволюционно устойчивой и продолжительной. В-третьих, внутренние контрольные узлы позволяют осуществить переход между модулями с экологически разными пищевыми каротиноидами – они являются “мостами” между экологическими группами (рис. 1d) (Badyaev, Morrison, 2018) и таким образом более постоянны и, соответственно, более представлены в филогенетических выборках.
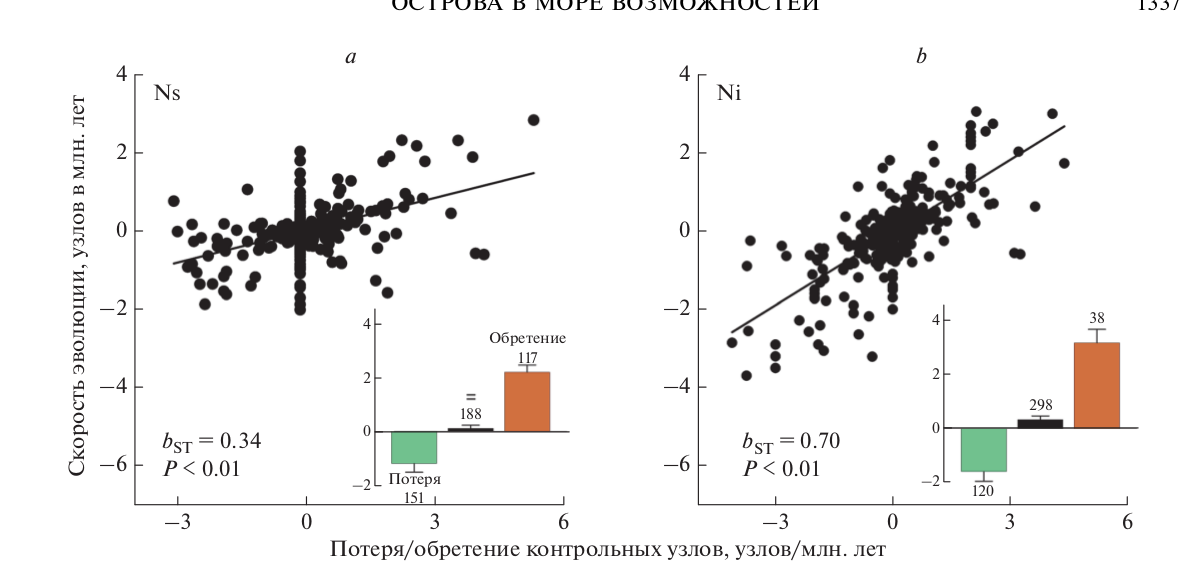
Рис. 4. Интернализация контроля над внешними каротиноидами ускоряет заполнение сети синтеза и, таким образом, ускоряет эволюцию и диверсификацию каротиноидных путей. Относительный вклад изменения (а) количества внешних контролей (Ns) и (b) количества внутренних контролей (Ni) в каротиноидных сетях птиц. На вставках показано среднее значение эволюционной скорости (узлы за мил. лет ± 1 стандартное отклонение) для потери, удержания и обретения контрольных узлов, соответственно.
Наши результаты показали, что обретение доминантного внутреннего контроля всегда ассоциируется с быстрыми темпами эволюции (рис. 4). Филогенетическое дерево изучаемых видов имеет 457 исторических изменений контрольного профиля. Только 38 (8.3%) из них включают приобретения нового внутреннего контроля, однако эти обретения объясняют 70% вариаций в скорости эволюции (рис. 4) – более чем любой другой из ранее изученных признаков. Эволюционный переход от доминантного внешнего к внутреннему контролю каротиноидного синтеза связан не только с многократным увеличением скорости эволюции окраски оперения, но и с диверсификацией этой окраски (рис. 5). Это происходит потому, что приобретение внутреннего контроля обеспечивает эволюционно устойчивое включение каротиноидов, метаболизируемых из разных пищевых предшественников, в функционнальные сети (Badyaev et al., 2019).
Таким образом, наши результаты показывают, что каротиноидная диверсификация птиц отражает структуру биохимической сети, возникшей задолго до происхождения птиц. Эта структура позволяет нам калибровать ожидаемую частоту конвергенций оперения и обуслoвливает разный потенциал разнообразия окраски среди таксономических и экологических групп птиц. Она объясняет, почему усложнение и разнообразие окраски оперения зависят от избыточности пищевых каротиноидов, и показывает, как интернализация контроля позволяет осуществлять эволюционные переходы между смежными метаболическими модулями с экологически специализированными пищевыми каротиноидами. Тем самым, эта структура механистически связывает адаптацию и эволюцию даже в признаках, полностью зависящих от локальных внешних факторов.
В более общем плане такой подход позволяет нам оценить, какая часть пространства глобальной биохимической сети каротиноидов (“море возможностей” в заглавии этой статьи) уже пройдена птицами в процессе эволюции и какие части останутся навсегда недоступными для них. Эти результаты также устанавливают механизмы, посредством которых изменения зависимостей между видами и их средой обитания определяют их эволюцию, что является давней и основополагающей целью эволюционной биологии (Северцов, 1934; Simpson, 1953; Van Valen, 1989).
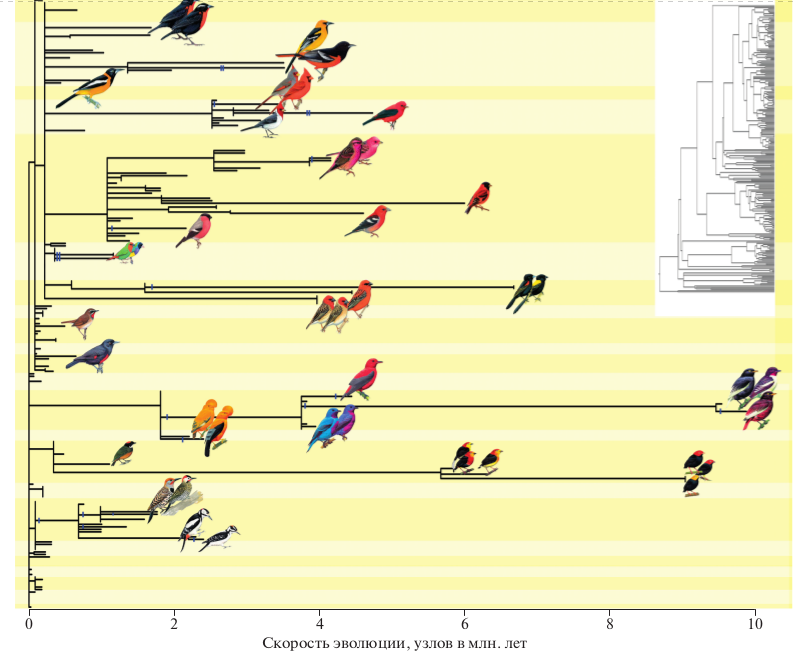
Рис. 5. Интернализация контроля обеспечивает диверсификацию каротиноидной окраски. Ветви ультраметрического филогенетического дерева 384 видов (вставка), умноженные на скорость эволюции (узлов за млн. лет), после чего длина большинство ветвей становится близкой к нулю. Однако обретение внутреннего контроля (вертикальный штрих) ассоциируется со значительным ускорением эволюции (удлинением ветвей) и диверсификацией. Фон разделяет таксономические семейства.
Список литературы
Коблик Е.А., Мосалов A.A., 2006. Окраска оперения птиц: типологизация и эволюция // Зоологический журнал. Т. 85. No 2. С. 266–282.
Мосалов A.A., Коблик Е.А., 2017. Окрасочные признаки, как маркеры базальных групп певчих воробьиных (Oscines, Passeriformes, Aves) // Труды Мензбир. орнитологического общества. Вып. 3. С. 96–111.
Северцов А.Н., 1934. Главные направления эволюционного процесса. М.- Л.: Биомедгиз. 150 с.
Шмальгаузен И.И., 1938. Организм как целое в индивидуальном и историческом развитии. Л.: АН СССР. 396 с.
Badyaev A. V., 2007. Evolvability and robustness in color displays: Bridging the gap between theory and data // Evolutionary Biology. V. 34. P. 61–71.
Badyaev A.V., 2019. Evolutionary transitions in controls reconcile adaptation with continuity of evolution // Seminars in Cell and Developmental Biology. V. 88. P. 36–45.
Badyaev A.V., Morrison E.S., 2018. Emergent buffering balances evolvability and robustness in the evolution of phenotypic flexibility // Evolution. V. 72. No 3. P. 647–662.
Badyaev A.V., Morrison E.S., Belloni V., Sanderson M.J., 2015. Tradeoff between robustness and elaboration in carotenoid networks produces cycles of avian color diversification // Biology Direct. V. 10. No 45. P. 1–22.
Badyaev A.V., Posner A.B., Morrison E.S., Higginson D.M., 2019. Cycles of external dependency drive evolution of avian carotenoid networks // Nature Communications. V. 10. P. 1596.
Badyaev A.V., Potticary A.L., Morrison E.S., 2017. Most colorful example of genetic assimilation? Exploring the evolutionary destiny of recurrent phenotypic accommodation // American Naturalist. V. 190. No 2. P. 266–280.
Baker R.R., Parker G.A., 1979. The evolution of bird coloration // Philosophical Transactions of the Royal Society of London. Series B. Biological Sciences. V. 287. No 1018. P. 65–130.
Bershtein S., Segal M., Bekerman R., Tokuriki N., Tawfik D.S., 2006. Robustness-epistasis link shapes the fitness landscape of a randomly drifting protein // Nature. V. 444. P. 929–932.
Borenstein E., Kupiec M., Feldman M.W., Ruppin E., 2008. Large-scale reconstruction and phylogenetic analysis of metabolic environments // Proceedings of the National Academy of Sciences of the United States of America. No 105. No 38. P. 14482–14487.
Britton G., 1998. Overview of carotenoid biosynthesis. In Britton G., Pfander H., Liaaen-Jensen S. (eds). Carotenoids. Biosynthesis and Metabolism. Basel: Birkhäuser. P. 13–147.
Brush A.H., 1978. Avian pigmentation. In A.H. Brush (ed.). Chemical Zoology. New York: Academic Press. P. 141–161.
Brush A.H., 1990. Metabolism of carotenoid-pigments in birds // The FASEB Journal. V. 4. No 12. P. 2969–2977.
Campbell C., Ruths J., Ruths D., Shea K., Albert R., 2015. Topological constraints on network control profiles // Science Reports. V. 5. P. 18693.
Chetverikov S.S., 1926. On certain aspects of the evolutionary process from the standpoint of modern genetics // Journal of experimental Biology. Series A. V. 2. P. 1–40.
Commault C., Dion J.M., van der Woude J.W., 2002. Characterization of generic properites of linear structured system for efficient computations // Kybernetika. V. 38. No 5. P. 503–520.
Dobzhansky T., 1937. Genetics and the Origin of Species. New York: Columbia University Press. 365 p.
Ebenhöh O., Handorf T., Kahn D., 2006. Evolutionary changes of metabolic networks and their biosynthetic capacities // IEE Proceedings Systems Biology. V. 153. No 5. P. 354–358.
Edelman G.M., Gally J.A., 2001. Degeneracy and complexity in biological systems // Proceedings of the National Academy of Sciences of the United States of America. V. 98. No. 24. P. 13763–13768.
Fontana W., Schuster P., 1998. Continuity in evolution: On the nature of transitions // Science. V. 280. No 1451. P. 1451–1455.
Frank S.A., 2018. Control Theory Tutorial: Basic Concepts Illustrated by Software Examples // Springer. Switzerland: Cham. 112 p.
Gavrilets S., 1999. A dynamical theory of speciation on holey adaptive landscapes // American Naturalist. V. 154. No 1. P. 1–22.1340
Goodwin T.W., 1984. Biochemistry of Carotenoids // V. 2. Animals. L.–New York: Chapman & Hall. 224 p.
Gould S.J., 2002. The Structure of Evolutionary Theory. Belknap Press, Harvard University Press, Cambridge, MA. 1435 p.
Hagberg A.A., Schult D.A., Swart P.J., 2008. Exploring network structure, dynamics, and function using NetworkX. In Varoquaux G., Vaught T., and Millman J., eds. Proceedings of the 7th Python in Science Conference (SciPy2008), USA, CA: Pasadena. P. 11–15.
Higginson D.M., Belloni V., Davis S.N., Morrison E.S., Andrews J.E., Badyaev A.V., 2016. Evolution of long-term coloration trends with biochemically unstable ingredients // Proceedings of the Royal Society of London. Series B, Biological Sciences. V. 283. P. 403.
Hill G.E., McGraw K.J. (eds)., 2006. Bird Coloration. Boston MA: Harvard University Press. 640 p.
Hopcroft J.E., Karp R.M., 1973. An n5/2 algorithm for maximum matching in bipartite // SIAM J. Computing. V. 2. No 4. P. 225–231.
Huynen M., Stadler P.F., Fontana W., 1996. Smoothness within ruggedness: the role of neutrality in adaptation // Proceedings of the National Academy of Sciences of the United States of America. V. 93. No 1. P. 397–401.
Jetz W., Thomas G.H., Joy J.B., Hartmann K., Mooers A.O., 2012. The global diversity of birds in space and time // Nature. V. 491. P. 444–448.
Jetz W., Thomas G.H., Joy J.B., Redding D.W., Hartmann K., Mooers A.O., 2014. Global distribution and conservation of evolutionary distinctness in birds // Current Biology. V. 24. No 9. P. 919–930.
Kayser H., 1982 Carotenoid in insects // In Britton G., Goodwin T.W., (eds). Carotenoid Chemistry and Biochemistry. Oxford: Pergamon Press. P. 195–210.
Klassen J.L., 2010. Phylogenetic and evolutionary patterns in microbial carotenoid biosynthesis are revealed by comparative genomics // PLoS One V. 5. P. e11257.
Kreimer A., Borenstein E., Gophna U., Ruppin E., 2008. The evolution of modularity in bacterial metabolic networks // Proceedings of the National Academy of Sciences of the United States of America. V. 105. No 19. P. 6976–6981.
Lewontin R.C., 1974. The Genetic Basis of Evolutionary Change. New York: Columbia University Press. Xiii + 346 p.
Liaaen-Jensen S., Andrewes A.G., 1972. Microbial carotenoids // Annual Review of Microbiology. V. 26. P. 225–248.
Liu Y.-Y., Slotine J.-J., Barabasi A.-L., 2011. Controllability of complex networks // Nature. V. 473. P. 167–173.
Maynard Smith J., 1970. Natural selection and the concept of a protein space // Nature. V. 225. P. 563–564.
Mithani A., Hein J., Preston G.M., 2011. Comparative analysis of metabolic networks provides insight into the evolution of plant pathogenic and nonpathogenic lifestyles in Pseudomonas // Molecular Biology and Evolution. V. 28. No 1. P. 483–499.
Mithani A., Preston G.M., Hein J., 2009. Rahnuma: hypergraph-based tool for metabolic pathway prediction and network comparison // Bioinformatics. V. 25. No 14. P. 1831–1832.
Mithani A., Preston G.M., Hein J., 2009a. A stochastic model for the evolution of metabolic networks with neighbor dependence // Bioinformatics. V. 25. No 12. P. 1528–1535.
Mithani A., Preston G.M., Hein J., 2010. A Bayesian approach to the evolution of metabolic networks on a phylogeny // PLoS Computational Biology. V. 6. No 8. P. e1000868.
Moradi A.A., Jalili M., Yu X., Stone L., 2017. Finding the most influential nodes in pinning controllability of complex networks // IEEE Transactions on Circuits and Systems II: Express Briefs. V. 64. P. 685–689.
Morris J.J., Lenski R.E., Zinser E.R., 2012. The Black Queen Hypothesis: evolution of dependencies through adaptive gene loss // MBio. V. 3. I. 2. 00036-12. 7 p.
Morrison E.S., Badyaev A.V., 2016. Structuring evolution: Biochemical networks and metabolic diversification in birds // BMC Evolutionary Biology. V. 16. P. 168.
Morrison E.S., Badyaev A.V., 2018. Structure versus time in evolutionary diversification of avian carotenoid networks // Journal of Evolutionary Biology. V. 31. No 5. P. 764–772.
Nam H., Lewis N.E., Lerman J.A., Lee D.-H., Chang R.L., Kim D., Palsson B.Ø., 2012. Network context and selection in the evolution to enzyme specificity // Science. V. 337. No 6098. P. 1101–1104.
Nordbotten J.M., Levin S.A., Szathmary E., Stenseth N.C., 2018. Ecological and evolutionary dynamics of interconnectedness and modularity // Proceedings of the National Academy of Sciences of the United States of America. V. 115. No 4. P. 750–755.
Pál C., Papp B., Lercher M.J., 2005. Adaptive evolution of bacterial metabolic networks by horizontal gene transfer // Nature Genetics. V. 37. No 12. P. 1372–1375.
Pellegrini M., Marcotte E.D., Thompson M.J., Eisenberg M.J., Yeates T.O., 1999. Assigning protein functions by comparative genome analysis: Protein phylogenetic profiles // Proceedings of the National Academy of Sciences of the United States of America V. 96. No 8. P. 4285–4288.
Ruths J., Ruths D., 2014. Control properties of complex networks // Science. V. 343. No 1373. P. 1373–1375.
Savalli U.M., 1995. The evolution of bird coloration and plumage elaboration: A review of hypothesis // Current Ornithology. V. 12. P. 141–190.
Sefc K.M., Brown A.C., Clotfelter E.D., 2014. Carotenoidbased coloration in cichlid fishes // Comparative Biochemical Physiology. Series A. Molecular Integrative Physiology. V. 173. P. 42–51.
Simpson G.G., 1953. The Major Features of Evolution. New York: Simon and Schuster. 103 p.
Starr T.N., Picton L.K., Thornton J.W., 2017. Alternative evolutionary histories in the sequence space of an ancient protein // Nature. V. 549. P. 409–413.
Umeno D., Tobias A.V., Arnold F.H., 2005. Diversifying carotenoid biosynthetic pathways by directed evolution // Microbiology and Molecular Biology Reviews. V. 69. No 1. P. 51–78.
Van Valen L. 1989. Three paradigms in evolution // Evolutionary Theory. V. 9. P. 1–17.
Wagner A., 2011. The Origins of Evolutionary Innovations: A theory of transformative change in living systems. New York: Oxford University Press. 272 p.
Whitacre J., Bender A., 2010. Degeneracy: a design principle for achieving robustness and evolvability // Journal of Theoretical Biology. V. 263. No 1. P. 143–153.
Yamada T., Kanehisa M., Goto S., 2006. Extraction of phylogenetic network modules from the metabolic network // BMC Bioinformatics. V. 7. P. 130.
Yuan Z., Zhao C., Di Z., Wang W.X., Lai Y.C., 2013. Exact controllability of complex networks // Nature Communications. V. 4. P. 2447.
Zhao J., Ding G.H., Tao L., Yu H., Yu Z.H., Luo J.H., Cao Z.W., Li Y.X., 2007. Modular co-evolution of metabolic networks // BMC Bioinformatics. V. 8. P. 311.
Zhou K., Doyle J.C., Glover K., 1996. Robust and Optimal Control. New Jersey: Prentice Hall. Englewood Cliffs. 586 p.
Зоологический журнал. 2019. Т.98. 312 (материалы 1го Всероссийского орнитологического конгресса в Твери, январь-февраль 2018 г.).