Резюме. Сегодня всё чаще фиксируется закономерность и предсказуемость адаптивной эволюции, в меру причинной связанности соответствующих «вызовов» среды и «ответов» на них в рамках данной организации: «типа», «плана строения», скажем, ящериц или древесных лягушек. Скажем, три вида ящериц — игуаны заборная Sceloporus cowlesi и глухая Holbrookia maculata, полосатая аризонская хлыстохвостая ящерица Aspidoscelis inornata — независимо заселили дюны гипсового песка близ озера Люсеро (национальный парк «Белые пески», штат Нью-Мексико США). Все они дали дали бледные формы, контрастирующие с бурой окраской предковых популяций на тёмных почвах: такая окраска хорошо защищает от пернатых хищников, но требует чаще и больше греться на солнце. Возможно поэтому данные по селективному изъятию хищниками глухих игуан нестабильны и противоречивы, см. перевод статьи Kayla M. Hardvick et al. (2015) в первой части.
Обладая большим альбедо, гипсовые пески нагреваются сильно меньше, чем обычные на основе кварца; из-за расворимости гипса в воде белые дюны движутся медленнее и твёрже обычных, они изменяемы не только ветром но и водными потоками. Это позволяет ящерицам быть активней, больше перемещаться даже в самые жаркие часы; хуже замечая опасность из-за сильного отражения, они могут чаще убегать от неё.
И только недавно выяснилось, что одна из трёх — пятнистая глухая игуана Holbrookia maculata — освоила независимо возникшие гипсовые дюны в другом регионе (Солёный Бассейн в национальном парке «Горы Гудуалупе», штат Техас), и там также дала бледную форму. Далее следует перевод статьи Laurentino et al., 2022, обосновывающей независимость происхождения обоих бледных форм глухой игуаны, показывающей их сходства («побледнение») и различия. Везде побледнение ящериц «создано» закреплёнными отбором мутациями в MC1R, но различными, приводящими к разным заменам в генетическом «тексте». У заборных игуан и хлыстохвостых ящериц замены значимы, снижают встраиваемость рецептора Mc1r в мембрану меланоцитов или ухудшая трансформацию сигнала рецептором соответственно. У глухих игуан замены, сопряжённые с побледнением, не показали заметного влияния на функцию Mc1r, что не исключает возможности участия изменившегося благодаря им рецептора в этом процессе. В любом случае, у популяций Белых песков и Солёного бассейна это разные замены. Эти две бледные популяции также различны по морфологии кисти, что согласуется с поведенческими различиями между ними.
***
Три вида ящериц — игуаны заборная Sceloporus cowlesi и пятнистая глухая Holbrookia maculata, полосатая аризонская хлыстохвостая ящерица Aspidoscelis inornata — независимо заселили дюны гипсового песка близ озера Люсеро (национальный парк «Белые пески», штат Нью-Мексико США). Все они дали бледные формы, контрастирующие с бурой окраской предковых популяций на тёмных почвах (Laurentino et al., 2022): такая окраска хорошо защищает от пернатых хищников, но требует чаще и больше греться на солнце.
Обладая большим альбедо, гипсовые пески нагреваются сильно меньше, чем обычные на основе кварца; из-за расворимости гипса в воде белые дюны движутся медленнее и твёрже обычных, они изменяемы не только ветром но и водными потоками. Дифференциация форм была быстрой: Белые пески появились ~ 7000 лет назад.
Неоднозначность изъятия хищниками в Белых песках
Это позволяет ящерицам быть активней, больше перемещаться даже в самые жаркие часы; хуже замечая опасность из-за сильного отражения, они могут чаще убегать от неё. Возникло предположение, что хищники, обитающие в Белых песках — головастый сорокопут Lanius ludovicianus и калифорнийская кукушка-подорожник Geococcyx californianus — осуществляли отбор, хватая преимущественно жертв, наиболее отличающихся от субстрата.
Реальность изъятия хищниками и его возможная селективность изучены в 2011 и 2012 гг. для вольер, выстроенных в Белых песках (по 3 повторности). Одни сверху были открыты (доступны хищникам), другие закрыты (затянуты сеткой). Туда помещали H.maculata, светлых, или покрашенных нетоксичной краской под тёмную морфу, и смотрели их выживаемость через 2 недели. Окрашивание отражало естественные цвета и не изменяло терморегуляционные способности ящериц. Ящерицы, окрашенные соответственно субстрату, яркостью спины значимо не отличались от H.maculata Белых песков (t45,99 = -1,61; P = 0,11); это верно и в отношении ящериц, не соответствующих субстрату, в сравнении с H.maculata тёмного грунта (t45,99 = -1,15, Р=0,25). И наоборот, ящерицы обоих категорий эксперимента значимо отличались друг от друга по яркости (t45,99 = 16,41, P<0,01), как и «природные» ящерицы светлой и тёмной популяций.
В закрытых вольерах выжили все ящерицы, в открытых — лишь 56%: кроме названных видов птиц, внутри и вокруг них также были отмечены белошейные вороны Corvus cryptoleucus и многоголосые пересмешники Mimus polyglottos. Следы хищных млекопитающих (койот Canis latrans) или змей (береговая гоферова змея Pituophis catenifer) отмечались всего несколько раз; практически все случаи хищничества осуществлены птицами: в оба года наблюдали их постоянное присутствие, следы или экскремены.

А — открытая, В — закрытая вольеры, С — экспериментальные ящерицы светлого vs тёмного облика (сверху) на фоне соответствующих природных субстратов (снизу), D — ящерицы, соответствующие субстрату и нет после выпуска в открытый вольер.
Этот эксперимент дал неожиданные результаты. Хотя ящерицы явно страдают от хищников, Kayla M. Hardvick et al. (2015) не удалось показать селективность изъятия не соответствующих субстрату. Возможно, на выживаемость ящериц влияют более тонкие различия, связанные с дифференцированным использованием микростаций разными полами (определяющим разницу в успешности бегства), нежели грубая дихотомия их общей окраски. Другое возможное объяснение — выживаемость больше зависит от дистанции до укрытий и скорости, с которой она пускается в бегство, нежели от фона окраски, т.е. ящерицы «рассчитывают» на собственную активность больше, чем на маскировку, а она, в свою очередь, модулируется гормональными изменениями, связанными с посветлением через те же биохимические процессы, которые обеспечивают синтез меланина из тирозина.
Действительно, выживаемость в открытых вольерах существенно различалась в 2011 и 2012 гг., при сильной зависимости от пола. В первом случае выжило лишь 36% ящериц, в том числе 38% среди соответствующих субстрату (95% доверительный интервал, ДИ 0%-100%) и 33% — среди не соответствующих (ДИ 13% — 53%, различия не значимы, χ21 = 0,02, P = 0,89).
Во втором случае выжил 61% ящериц (95% ДИ [42%, 80%]): 59% (95% ДИ [37%, 81%]) соответствующих субстрату, и 63% (95% ДИ [37%, 81%]). [46%, 80%]) нет. Регрессионный анализ (общая линейная модель) показывает, что выживаемость ящериц не зависит от обработки краской (χ21 = 0,037, P=0,85), но зависит от года наблюдений и местоположения вольера. В 2012 г. она значимо выше, чем в 2011 г. (χ21 = 4,46, P=0,03); в оба года наблюдений выживаемость значимо различалась между вольерами (χ23 = 37,58, P<0,01). Метод повторного отлова и мечения показал, что в двух вольерах выживаемость была высока: 67% (95% ДИ [5%, 100%]) и 86% (95% ДИ [62%, 100%]), в других двух значимо ниже: 41% (95% % ДИ [11%, 71%]) и 31% (95% ДИ [11%, 51%]).
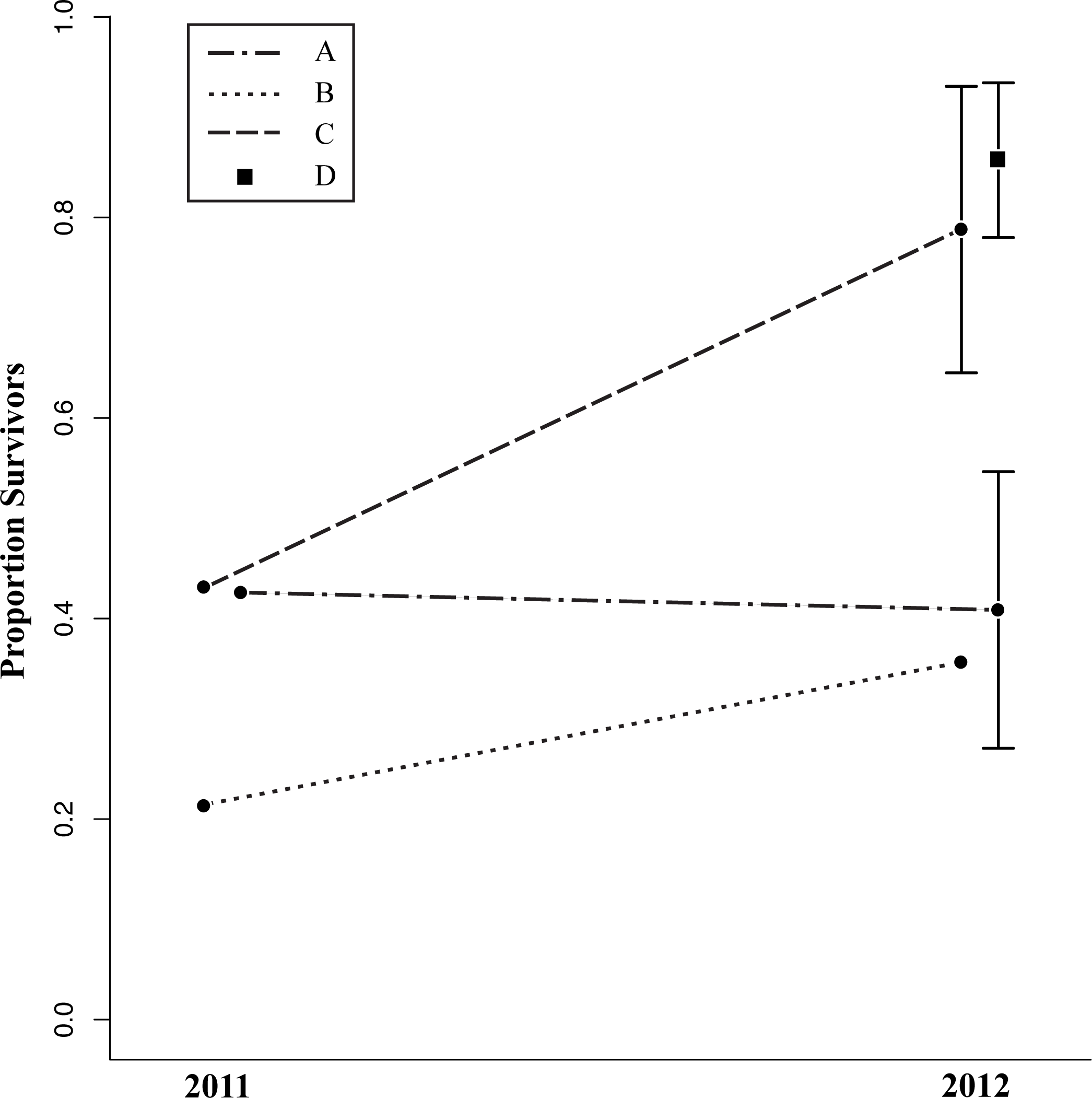
Изменения шансов на выживание по годам в разных ограждениях (А-D). Пунктир — влияние взаимодействие года и вольера на выживаемость, конечные точки — средняя доля выживших по повторностям разных вольеров в разные годы. Скобочки — стандартная ошибка средней за годы с несколькими повторностями. У вольера А была 1 повторность в 2011 г. и 4 в 2012, [n = 70 ящериц]; В и С — 1 в 2011 г. и 2 в 2012 г. [n = 42 ящерицы].
Была показана значимая взаимосвязь года наблюдений с расположением вольера (χ22=7,11, P=0,03), в одних из них она различалась по годам, в других нет. Однако при отдельном анализе перекрашенных самцов и самок селективность изъятия выявлена на уровне тенденции (для связи между типом окрашивания и полом χ21 = 3,64, P = 0,05). У самцов выживают больше соответствующие субстрату 58% (95% ДИ [38%, 78%] против 48% (95% ДИ [28%, 68%]), у не соответствующих, у самок наоборот: 67% (95% ДИ [53%, 81%]) не соответствующих и лишь 50% (95% ДИ [27%, 73%]) соответствующих. Возможно, это следствие присущей самцам игуан территориальности: патрулируя и охраняя участок, ухаживая за самками, они более заметны и ведут себя демонстративней, почему именно здесь маскировочная окраска может быть значима.
Однако сравнение выживаемости обоих типов перекрашенных ящериц отдельно для самцов и самок показало незначимость этих различий в обоих случаях (тест Фишера, P = 0,23 для самцов и P = 0,12 для самок). Возможно, потому, что недостаточен был объём выборки. Чтобы показанные различия были значимы, потребовалось бы ловить 350 самцов репродуктивного возраста, что снизит численность популяции (в Белых песках и так малочисленной) и её генетическую изменчивость. Также возможно, что эффективный отбор имел место в прошлом, когда численность пернатых хищников была выше. С 1966 г. численность головастых сорокопутов падает по всей стране, и сильнее всего в Нью-Мексико из-за антропогенных факторов.
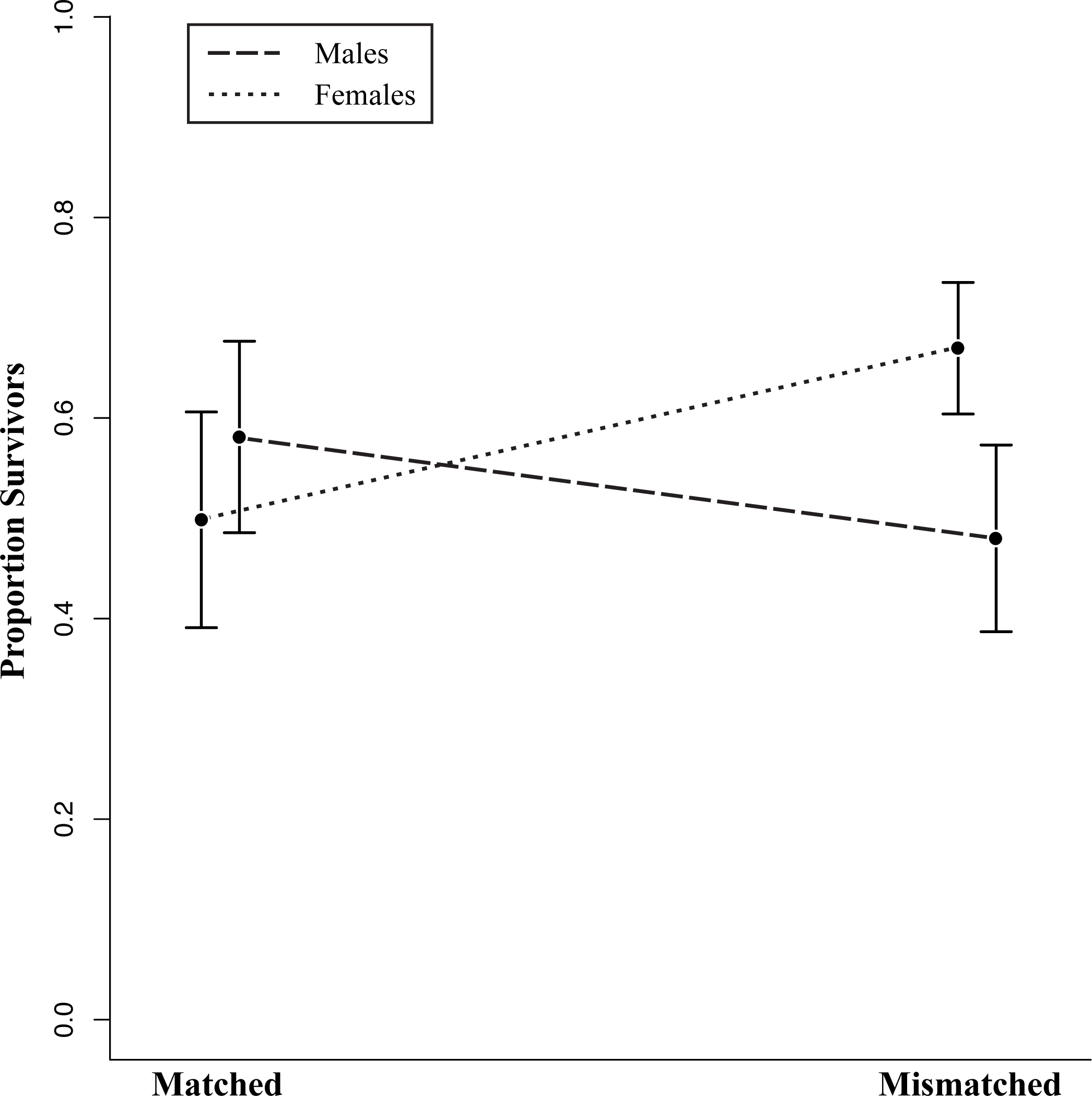
Выживаемость ящериц разной экспериментальной окраски отдельно для самцов и самок. Скобоки — ошибка средней; использованы данные 15 открытых повторностей за 2011 и 2012 гг., всего 210 ящериц
Наконец, размер ящерицы (длина до анального отверстия) значимо не влияет на выживаемость (χ21 = 2,94, P = 0,09). Выживаемость значительно различалась между годами (P = 0,03) и между ограждениями (P <0,01) в нашей общей линейной модели. Кроме того, мы обнаружили взаимосвязь между годом и вольером (P = 0,03), когда выживаемость в некоторых вольерах значительно различалась по годам, а выживаемость в других вольерах — нет.
Оригинал в PloS One
Параллельно возникшая светлая форма H.maculata: сходства и отличия от агам Белых песков
Недавно выяснилось, что одна из трёх — пятнистая глухая игуана Holbrookia maculata — освоила независимо возникшие гипсовые дюны в другом регионе (Солёный Бассейн в национальном парке «Горы Гудуалупе», штат Техас), на расстоянии примерно 160 км от этой (99,4 миль). Там она также дала бледную форму (Laurentino et al., 2022, fig.1). На рисунках и в дальнейшем анализе цветом показано происхождение ящериц: светло-серым — из Белых песков (WS) или Солёного бассейна (SBD), бурым — соседние с ними «тёмные» популяции, оранжевым — популяция между двумя светлыми (также «тёмная»).
 Независимость её появления подтверждена генеалогическим деревом популяций, включающим обе аллопатричные светлые формы, и разделяющих их «бурых» ящериц, построенным по митохиндриальному гену ND4 и гену меланокортинового рецептора 1 типа MC1R (Laurentino et al., 2022, fig.2).
Независимость её появления подтверждена генеалогическим деревом популяций, включающим обе аллопатричные светлые формы, и разделяющих их «бурых» ящериц, построенным по митохиндриальному гену ND4 и гену меланокортинового рецептора 1 типа MC1R (Laurentino et al., 2022, fig.2).
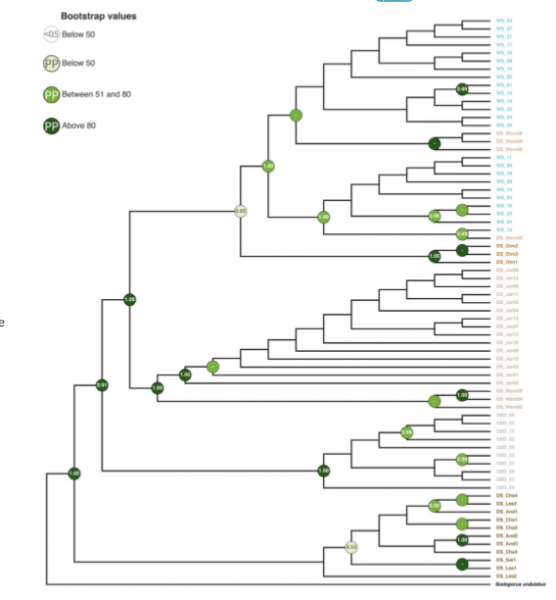
Рис.2. Дерево популяций, построенное по ND4 (сверху) и MC1R (снизу).
Везде побледнение ящериц «создано» закреплёнными отбором мутациями в MC1R, но различными, приводящими к разным заменам в генетическом «тексте». У заборных игуан и хлыстохвостых ящериц замены значимы, снижают встраиваемость рецептора MC1R в мембрану меланоцитов или ухудшая трансформацию сигнала рецептором соответственно. У глухих игуан замены, сопряжённые с побледнением, не показали заметного влияния на функцию MC1R, что не исключает возможности участия изменившегося благодаря им рецептора в этом процессе. В любом случае, у популяций Белых песков и Солёного бассейна это разные замены (Laurentino et al., 2022).
Каждая светлая популяция произошла от ближайшей тёмной (а тёмные дивергировали в соответствии с изоляцией расстоянием); но повторяемость их эволюции настолько велика, что количественный анализ побледнения, по яркости краски верха, показывает отсутствие значимых различий (Laurentino et al., 2022, fig.3).
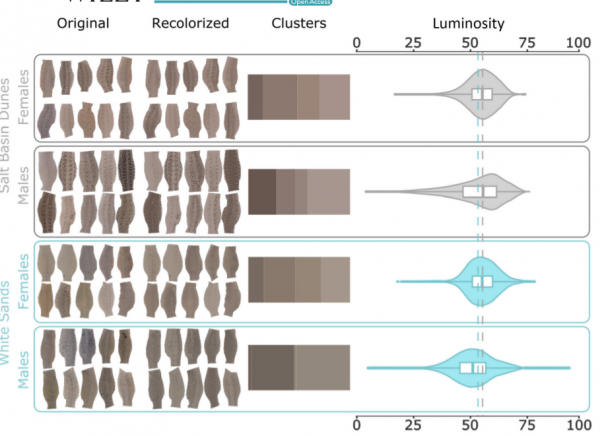
Рис.3. Побледнение верха, оцененное количественно, по яркости. Чем выше балл яркости, тем бледнее верх ящерицы.
Параллельные изменения окраски здесь сопряжены с морфологической дивергенцией. Конечности игуан Солёного Бассейна длинней как сравнительно с «бурыми» популяциями, так и с игуанами Белых песков (относительно размера тела). У них явственно удлинён задний палец: различия по его величине между теми же популяциями значимы при незначимости различий в длине бедра. Обе светлые формы крупнее и тяжелее соседних «бурых» популяций, почему ждёшь одинакового удлинения пальцев, однако у игуан Белых песков оно не отмечено (Laurentino et al., 2022, fig.4).
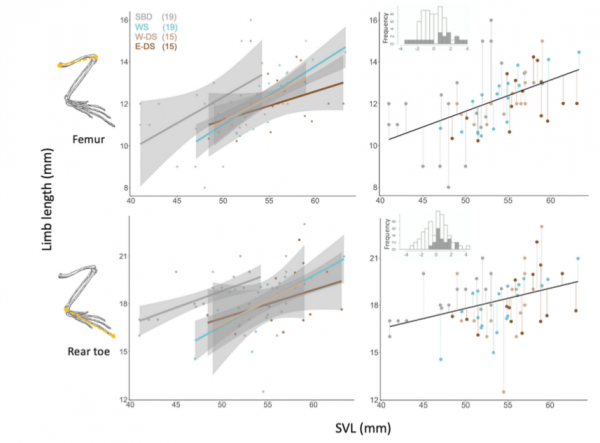 Морфологические различия игуан Солёного бассейна и Белых песков хорошо согласуются с поведенческими. Первые много лазают по растительности, регулярно используют стебли трав, стволы юкк и ветви полыни как насесты, для отдыха и засады. 3 из 25 ящериц (12%), использованных в анализе, были отловлены именно там (Laurentino et al., 2022, fig.5). В Белых песках же подобного поведения они избегают, хотя такая возможность имеется (по сообщениям 6 авторов, вместе исследовавших их там ~20 лет подряд).
Морфологические различия игуан Солёного бассейна и Белых песков хорошо согласуются с поведенческими. Первые много лазают по растительности, регулярно используют стебли трав, стволы юкк и ветви полыни как насесты, для отдыха и засады. 3 из 25 ящериц (12%), использованных в анализе, были отловлены именно там (Laurentino et al., 2022, fig.5). В Белых песках же подобного поведения они избегают, хотя такая возможность имеется (по сообщениям 6 авторов, вместе исследовавших их там ~20 лет подряд).
Поведенческие различия между независимо возникшими «светлыми» популяциями, возможно, созданы разницей биотических взаимоотношений H.maculata с другими ящерицами гипсовых песков. В Белых песках растительность регулярно использует конкурент, заборная игуана, и её «побледневшие» популяции предсказуемо отличаются от «бурых» именно удлинением задних пальцев, абсолютным и относительным (!), сопряжённым с расширением топической ниши.
В Солёном бассейне заборные игуаны отсутствуют, при наличии наземного хищника, длинноносой леопардовой ящерицы Gambelia wislizenii. Эта опасность дополнительно стимулирует освоение надземного яруса.
Другое различие, в величине головы, так и осталось необъяснённым, при всей существенности в функциональной экологии ящериц (корреляция с силой укуса и способностями к рытью). Сравнительно с ближайшими «бурыми» популяциями у глухих игуан в Белых песках головы увеличены, в Солёном бассейне — нет. Нет и сближения с первыми по этому признаку (Laurentino et al., 2022).
Оригинал в Ecology and Evolution.